
【题目】下列与化学概念有关的说法正确的是( )
A. Na2O、CaO、Al2O3均为碱性氧化物
B. 液溴不导电,所以液溴是非电解质
C. 12C与13C的核外电子排布方式相同,化学性质相同
D. 只含共价键的物质一定是共价化合物
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案测定某品牌茶叶中钙元素的质量分数,并检验铁元素的存在(已知CaC2O4为白色沉淀物质).首先取200g茶叶样品焙烧得灰粉后进行如图操作:

请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
离子 | Ca2+ | Fe3+ |
完全沉淀时的pH | 13 | 4.1 |
实验前要先将茶叶样品高温灼烧成灰粉,其主要目的 .
(2)写出从滤液A→沉淀D的离子反应方程式 .
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,试判断沉淀D已经洗涤干净的方法是 .
(4)用KMnO4标准溶液滴定C溶液时所发生的反应为:5C2O42﹣+2MnO4﹣+16H+═10CO2↑+2Mn2++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000molL﹣1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.
①此步操作过程中需要用到图2中哪些仪器(填写序号) ;

②滴定到终点,静置后,如图3方法读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将 (填“偏高”“偏低”或“无影响”).
(5)原茶叶中钙元素的质量分数为 .
(6)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氢化物——氨,是重要的化工原料,在工农业生产中有广泛的应用。而烟气中的NOx必须脱除(即脱硝)后才能排放。
(1)合成氨原料氢气的一个制备反应为:CO+H2O(g)![]() CO2+H2
CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_________(填计算结果)。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α(H2O)=______________________。
(2)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);
4NO(g)+6H2O(g);
△H=-905kJ·mol-1
不同温度下NO产率如图所示。温度高于900℃时,
NO产率下降的原因____________。

(3)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-890.3kJ·mol-1
N2(g)+O2(g)=2NO(g); ΔH=+180kJ·mol-1
CH4可用于脱硝,其热化学方程式为______________________。
(4) 以NO2、O2、熔融NaNO3组成的燃料电池装置如下图所示,
在使用过程中石墨I电极反应生成一种氧化物Y,有关电极
反应可表示为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)下列叙述正确的是( )。
4NO(g)+6H2O(g)下列叙述正确的是( )。
A. 达到平衡时:4v正(O2)=5v逆(NO)
B. 若单位时间内生成xmol NO的同时,消耗xmol NH3,则反应达到平衡状态。
C. 达到平衡时,若增加容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应的速率关系是:2v正(NH3)=3v逆(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
选项 | 微粒组 | 所加试剂 | 离子方程式 |
A | NH | 少量Ba(OH)2溶液 | 2NH |
B | Mg2+、Cl-、HCO | 过量NaOH溶液 | Mg2++2HCO |
C | Fe2+、NO | NaHSO4溶液 | HSO |
D | K+、CO | 通入少量CO2 | CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, 平衡常数减小 | 0~3s内,反应速率为: v(NO2)=0.2molL-1 | t1时仅加入催化剂, 平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH =a KJ/mol
CO(g)+2H2(g)=CH3OH(g) ΔH =b KJ/mol
试写出由CH4和O2制取甲醇的热化学方程式: 。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率v(H2)= 。
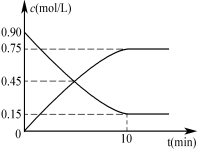
甲图
(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示。

乙图
①下列说法能判断该反应达到化学平衡状态的是_______。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍 B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10molCO和20 molH2,则在平衡状态B时容器的体积V(B)= L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。若KOH溶液足量,则写出电池总反应的离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴加一滴Na2S溶液并振荡,沉淀又变成黑色。根据上述变化过程,分析此三种沉淀物的溶解度关系为( )
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中所有原子都满足最外层为8电子结构的是( )
① BeCl ② NC13③ PCl5④ COC12⑤ SF6⑥ XeF2⑦ CS2 ⑧CH4⑨CF2C12⑩ S2C12
A. ②④⑦⑧⑧⑨⑩ B. ②④⑦⑨⑩ C. ③④⑦⑩ D. ③④⑤⑦⑨⑩
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com