
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。

完成下列各题:
(1)乙炔在一定条件下制取苯的化学反应方程式是_________________________。
(2)正四面体烷的分子式为___________,其二氯取代产物有__________种。
(3)关于乙烯基乙炔分子的说法正确的是__________。
A.由乙炔通过取代反应制得
B.能使酸性KMnO4溶液褪色
C.1 mol乙烯基乙炔能与3 mol Br2发生加成反应
D.等物质的量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同
(4)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式有_________。
【答案】 3C2H2 ![]()
![]() C4H4 1 BC
C4H4 1 BC ![]()
【解析】(1)三分子乙炔在一定条件下制取苯;
根据正四面体烷的键线式可得其分子式为C4H4;其一氯代物只有一种,一氯代物的等效氢只有一种,所以其二氯取代产物也只有一种。
A.乙烯基乙炔由两分子乙炔通过加成反应制得;
B.含有不饱和键,能使酸性KMnO4溶液褪色;
C.1 mol乙烯基乙炔和 Br2完全反应消耗3 mol Br2;
D.因等质量的烃(CXHY)完全燃烧时耗氧量取决于y/x,而乙烯基乙炔为CH2=CH-C≡CH最简式为CH,乙炔C2H2的最简式为CH,二者最简式相同,二者质量相同,消耗氧气相同;
(4)环辛四烯的分子式为C8H8,不饱和度为5,属于芳香烃的同分异构体,含有1个苯环,侧链不饱和度为1,故含有1个侧链为-CH=CH2。
(1)三分子乙炔在一定条件下制取苯,该反应的化学方程式为:
![]()
(2)根据正四面体烷的键线式可得其分子式为C4H4;其一氯代物只有一种,一氯代物的等效氢只有一种,所以其二氯取代产物也只有一种。
(3)A.乙烯基乙炔由两分子乙炔通过加成反应制得,故A错误;
B.含有不饱和键,能使酸性KMnO4溶液褪色,故B正确;
C.1 mol乙烯基乙炔和 Br2完全反应消耗3 mol Br2,故C正确;
D.因等质量的烃(CXHY)完全燃烧时耗氧量取决于y/x,而乙烯基乙炔为CH2=CH-C≡CH最简式为CH,乙炔C2H2的最简式为CH,二者最简式相同,二者质量相同,消耗氧气相同,故D错误.
故答案为:BC;
(4)环辛四烯的分子式为C8H8,不饱和度为5,属于芳香烃的同分异构体,含有1个苯环,侧链不饱和度为1,故含有1个侧链为-CH=CH2,属于芳香烃的同分异构体的结构简式![]() ,
,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】将铜纳米颗粒和银纳米颗粒相隔一定距离固定在石墨片上,然后浸在AgNO3溶液中,可构成一种纳米型原电池。该电池负极发生的反应为( )
A. Ag++e—===Ag
B. Cu-2e—===Cu2+
C. Cu2++2e—===Cu
D. 2H++2e—===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某锂离子电池工作原理如下图所示,电池反应为:Li1-xCoO2+LixC![]() LiCoO2+C。下列说法不正确的是
LiCoO2+C。下列说法不正确的是
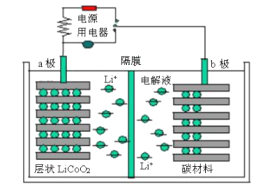
A. 放电时,电子从b极经用电器流向a极
B. 放电时,若转移1mol e-,碳材料将增重7 g
C. 充电时,锂离子通过隔膜进入右室
D. 充电时,a极反应:LiCoO2-xe-= Li1-xCoO2+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙是三种常见的单质,A、B、C是三种常见的二元无机化合物,它们之间的转化关系如右图所示。请回答下列有关问题:
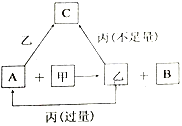
(1)若甲为常见气态非金属单质,丙为金属单质,三种单质中只有甲由短周期元素组成;甲与乙同主族、乙与丙同周期;它们的转化关系均在溶液中进行。则:
①甲物质的名称为___________。
②丙元素在元素周期表中的位置是___________。
③反应A+甲→乙+B的离子方程式为______________________。
④请简述B中阳离子的检验方法__________________________________。
(2)若甲为常见金属单质,乙为常见固态非金属单质,且所有物质组成元素均为短周期元素。则:
①乙的化学式为___________。
②A的电子式为___________。
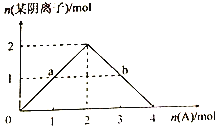
③将A缓慢通入氢氧化钠溶液中,所得溶液中的某种阴离子的物质的量随n(A)的通入转化关系如右图所示。图中a、b两点的溶液中水的电离程度的大小关系为a_______b(填“>”、“=”或“<")。若溶液X为图中曲线上任意一点,则向溶液X中逐滴加入盐酸至反应完全,消耗盐酸的物质的量最大为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是一种熔点高、硬度大、无磁性的金属,广泛应用于钢铁、航空航天、能源、化工等领域。目前工业上使用一种新工艺,以便从冶炼铝的固体废料一赤泥中提取金属钒,赤泥主要含有Fe2O3、Al2O3、V2O5和CuO,具体工艺流程图如下:
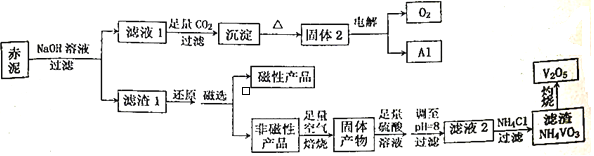
已知:钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,且存在平衡VO2++H2O![]() VO3-+2H+。回答下列问题:
VO3-+2H+。回答下列问题:
(1)磁性产品的化学式为_________________________。
(2)赤泥加入NaOH溶液,发生的离子反应方程式为___________________。能否用氨水代替NaOH溶液,___________(填“能”或“不能”),理由是___________________________________________。
(3)滤液1生成沉淀的离子反应方程式为_________________________________________。
(4)调至pH=8的目的有两个,一是___________________,二是使VO2+转化为VO3-,此时溶液中VO2+和VO3-的物质的量之比为a:b,VO2++H2O![]() VO3-+2H+的平衡常数K=____________________。
VO3-+2H+的平衡常数K=____________________。
(5)滤液2加氯化铵生成NH4VO3的离子方程式为__________________________,该反应能发生是因为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A、B、C、D、E、G均为元素周期表前四周期元素,原子序数依次增大。A 元素原子核外电子分占3 个不同能级,且每个能级上排布的电子数相同;B 元素的简单气态氢化物与最高价氧化物的水化物反应生成盐;C 元素为非金属元素且基态原子的p 能级上电子数比s能级上电子数多1;D元素的原子序数等于B、C两元素原子序数之和,E 是前四周期元素中基态原子中含单电子数最多的元素;G元素位于周期表第11纵行。
(1)E属于____区的元素,其基态原子的核外电子排布式为_____________________。
(2)五种元素中,电负性最大的是__________________(填元素符号)。
(3)B与其同周期相邻元素第一电离能由大到小的顺序为____________________(用元素符号表示)。
(4)下图是已经合成的最著名的“D-B”化合物的分子结构。“D-B”化合物在研磨或迅速加热时会剧烈分解并引起爆炸,生成非常稳定的两种单质分子(相对分子质量之比为7:64),发生反应的化学方程式为____________。
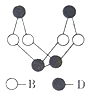
(5)A 元素的最高价含氧酸根离子( 只含A 和氧两种元素)的空间构型为__________________,该酸根离子的中心原子的轨道杂化类型为________________________,与该酸根离子互为等电子体的一种分子为______(填化学式)。
(6)已知G 与C1元素的某种化合物的晶胞结构如图所示: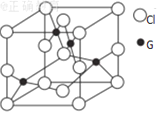 则该化合物的化学式是__________,若G 与Cl原子最近的距离为a cm,则该晶体的密度为_________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
则该化合物的化学式是__________,若G 与Cl原子最近的距离为a cm,则该晶体的密度为_________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )

①Zn为正极,Cu为负极;②H+向负极移动;③电子是由Zn经外电路流向Cu;④Cu极和Zn极上都有H2产生;⑤产生的电流迅速减小;⑥正极的电极反应式为Zn-2e-=Zn2+
A. ①②③ B. ③④⑤ C. ④⑤⑥ D. ②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com