
| A. | 测0.1mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- | |
| C. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ | |
| D. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3+3H+ |
分析 A、氨水中存在如下电离平衡:NH3•H2O?NH4++OH-;
B、碳酸钠溶液中碳酸根离子水解导致溶液显碱性;
C、钢铁发生吸氧腐蚀时,铁作负极被氧化;
D、明矾中的铝离子水解生成的氢氧化铝胶体具有净水作用.
解答 解:A、氨水中存在如下电离平衡:NH3•H2O?NH4++OH-,0.1mol/L氨水的氢氧根离子浓度小于0.1mol/L,pH为11,故A正确;
B、碳酸钠溶液中碳酸根离子水解导致溶液显碱性,CO32-+H2O?HCO3-+OH-,故B正确;
C、钢铁发生吸氧腐蚀时,铁作负极被氧化,电极反应式为:Fe-2e-=Fe2+,故C错误;
D、明矾中的铝离子水解生成的氢氧化铝胶体具有净水作用,即Al3++3H2O?Al(OH)3+3H+,故D正确.
故选C.
点评 本题涉及盐的水解原理的应用、金属的吸氧腐蚀原理、弱电解质的电离过程等方面的知识,属于综合知识的考查,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 该物质一定是钠的化合物 | B. | 该物质一定含钠元素 | ||
| C. | 该物质一定是单质钠 | D. | 能确定是否含钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①与②分别与足量镁粉反应,生成H2的量:①<② | |
| B. | ②和③混合,所得混合溶液的pH大于7 | |
| C. | ③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③=④ | |
| D. | 若将四种溶液稀释100倍,溶液pH大小顺序:③>④>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | n值为2 | |
| B. | 氧化产物与还原产物的物质的量比为2:5 | |
| C. | n值为3 | |
| D. | 氧化性R2O8n->MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,电池的负极质量减轻 | |
| B. | 放电时,正极周围的pH升高 | |
| C. | 充电时,电池中硫酸的浓度不断减小 | |
| D. | 充电时,阳极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在钠、钾、铷三种单质中,钠的熔点最高 | |
| B. | 所有碱金属均为银白色 | |
| C. | 同一主族卤素单质从上到下熔沸点依次升高 | |
| D. | 液溴易挥发,可以通过水封的方式进行保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
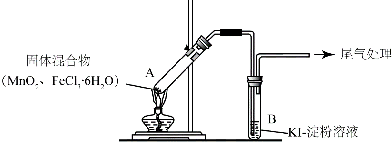
| 操作 | 现象 |
| 点燃酒精灯,加热 | iA中部分固体溶解,上方出现白雾 ii稍后,产生黄色气体,管壁附着黄色液滴 iiiB中溶液变蓝 |
| 方案1 | B中溶液变为蓝色 |
| 方案2 | B中溶液呈浅橙色;未检出Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com