
| A. | ①与②分别与足量镁粉反应,生成H2的量:①<② | |
| B. | ②和③混合,所得混合溶液的pH大于7 | |
| C. | ③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③=④ | |
| D. | 若将四种溶液稀释100倍,溶液pH大小顺序:③>④>①>② |
分析 A.pH=3的CH3COOH溶液和pH=3的HCl溶液中c(H+)均为10-3mol/L,醋酸的浓度大于10-3mol/L;
B.一水合氨为弱碱,不能完全电离,故PH=11的氨水中c(NH3•H2O)>10-3mol/L,而②中c(HCl)=10-3mol/L;
C.一水合氨为弱碱,不能完全电离,故PH=11的氨水中c(NH3•H2O)>10-3mol/L,pH=4的NaOH溶液浓度为10-4mol/L;
D.加水稀释促进弱电解质的电离,溶液的pH变化小于2个单位.
解答 解:A、pH=3的CH3COOH溶液和pH=3的HCl溶液中c(H+)均为10-3mol/L,醋酸的浓度大于10-3mol/L,所以分别与足量镁粉反应,生成H2的量:①>②,故A错误;
B.一水合氨为弱碱,不能完全电离,故PH=11的氨水中c(NH3•H2O)>10-3mol/L,而②中c(HCl)=10-3mol/L,则两者混合后氨水过量,故所得溶液中除NH4Cl外,还有过量的氨水,所得混合溶液的pH大于7,故B正确;
C.一水合氨为弱碱,不能完全电离,故PH=11的氨水中c(NH3•H2O)>10-3mol/L,pH=11的NaOH溶液浓度为10-3mol/L,所以③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③>④,故C错误;
D.①pH=3的CH3COOH溶液,加水稀释促进弱电解质的电离,溶液的pH变化小于2个单位,pH<5 ②pH=3的盐酸,稀释100倍,pH=5,③pH=11的氨水加水稀释促进弱电解质的电离,溶液的pH变化小于2个单位,pH>9,④pH=11的NaOH溶液,稀释100倍,pH=9,所以溶液pH大小顺序:③>④>②>①,故D错误.
故选B.
点评 本题考查了弱电解质溶液中的电离平衡应用,题目难度不大,主要是强酸、弱酸、强碱、弱碱溶液稀释、pH的大小比较,弱电解质电离平衡的移动的判断.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:填空题
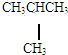
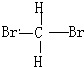 和
和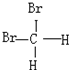 E.葡萄糖和果糖F.(CH3)2CHCH3与C(CH3)4
E.葡萄糖和果糖F.(CH3)2CHCH3与C(CH3)4查看答案和解析>>
科目:高中化学 来源: 题型:选择题
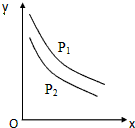 反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 增加L平衡右移 | ||
| C. | a>b | D. | a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测0.1mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- | |
| C. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ | |
| D. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期 IA族 | B. | 第二周期 VIIA族 | C. | 第三周期 IA族 | D. | 第三周期 VIIA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤X中可用MnO2代替双氧水 | |
| B. | 步骤Y中所用的玻璃仪器一定有分液漏斗 | |
| C. | 步骤Y中可用酒精代替CCl4 | |
| D. | 由于碘易升华,步骤Z中不能采取加热蒸发 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com