
【题目】(1)氨气易溶于水生成氨水,氨水电离生成铵根离子,铵根离子中氮原子采取________杂化,NH4+中HNH键角比NH3中HNH键角大,原因是__________________。
(2)Cu3N形成的晶体结构如图所示,N3-的配位数是________________。

(3)常温常压下,给水施加一个弱电场便可形成冰,称之为“热冰”,热冰中微粒间存在的作用力有________,其大小顺序是__________。
(4)NaF和NaCl属于同一主族的钠盐,但NaF的莫氏硬度比NaCl大,原因是__________。
【答案】 sp3 氨气分子中氮原子上有一对孤电子对,铵根离子中氮原子上没有孤电子对,排斥力小 6 化学键、范德华力、氢键 化学键>氢键>范德华力 相同类型的离子晶体,晶格能与离子半径成反比,离子晶体的晶格能越大,其莫氏硬度越大,氟离子半径小于氯离子半径,所以氟化钠的晶格能大于氯化钠,则NaF的莫氏硬度比NaCl大
【解析】(1)铵根离子中含有4个键,没有孤电子对,氮原子采取sp3杂化,氨气分子中氮原子上有一对孤电子对,铵根离子中氮原子上没有孤电子对,排斥力小,因此NH4+中H-N-H键角比NH3中H-N-H键角大。(2)N3-个数=8×![]() =1,Cu+个数=12×
=1,Cu+个数=12×![]() =3,所以3-的配位数为6(上下、前后、左右)。(3)热冰中微粒间存在的作用力有化学键、范德华力、氢键,微粒间作用力大小顺序是化学键>氢键>范德华力。(4)由于相同类型的离子晶体,晶格能与离子半径成反比,离子晶体的晶格能越大,其莫氏硬度越大,氟离子半径小于氯离子半径,所以氟化钠的晶格能大于氯化钠,则NaF的莫氏硬度比NaCl大。
=3,所以3-的配位数为6(上下、前后、左右)。(3)热冰中微粒间存在的作用力有化学键、范德华力、氢键,微粒间作用力大小顺序是化学键>氢键>范德华力。(4)由于相同类型的离子晶体,晶格能与离子半径成反比,离子晶体的晶格能越大,其莫氏硬度越大,氟离子半径小于氯离子半径,所以氟化钠的晶格能大于氯化钠,则NaF的莫氏硬度比NaCl大。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. BaCrO4(s)![]() Ba2+(aq)+CrO42-(aq)的平衡体系中,加入BaCl2浓溶液沉淀量增多
Ba2+(aq)+CrO42-(aq)的平衡体系中,加入BaCl2浓溶液沉淀量增多
B. pH=2的酸溶液与pH=12的强碱溶液等体积混合,所得溶液pH≤7
C. 苯酚显色原理为:6C6H5OH+Fe3+![]() Fe(C6H5O)63-(紫色)+6H+,则检验水杨酸(
Fe(C6H5O)63-(紫色)+6H+,则检验水杨酸(![]() )中的酚羟基,需加入适量的小苏打溶液后,再加入氯化铁溶液
)中的酚羟基,需加入适量的小苏打溶液后,再加入氯化铁溶液
D. 某试液中加入盐酸酸化的氯化钡溶液有白色淀淀,该试液中一定含有SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。
(1)基态E原子的价电子排布式为________________________;
(2)AB32-的立体构型是____________,其中A原子的杂化轨道类型是___________________________。
(3)A22-与B22+互为等电子体,B22+的电子式可表示为________________,1molB22+中含有的π键数目为________________________。
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键___________________。
(5)化合物DC2的晶胞结构如图所示,该离子化合协晶体的密度为ag/cm3,则晶胞的体积是_________________(只要求列算式,阿伏加德罗常数的值为NA)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. 同周期元素中,ⅦA族元素的原子半径最大
B. ⅥA族元素的原子,其半径越大,越容易得到电子
C. 室温时,0族元素的单质都是气体
D. 元素周期表中,从ⅢB到ⅡB这10个纵行的元素都是副族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果汁饮料中含有Fe2+,鲜榨的苹果汁在空气中会由淡绿色变为棕黄色,榨汁时加入维生素C可有效防止这种现象发生,说明维生素C具有
A.氧化性B.还原性C.酸性D.碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晚上,婷婷向爸妈介绍了自己学过的安全知识。以下说法不正确的是( )
A. 装修房屋时宜选用环保材料
B. 液化气罐漏气可用明火检验
C. 家用电器着火,应先关闭电源,再用二氧化碳灭火器灭火
D. 煤气热水器应安装在通风效果良好的地方,使用时保持通风
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应NO2(g)+ CO(g) ![]() CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是
CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是
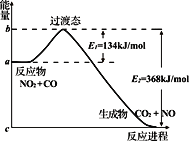
A. 1molNO2与1molCO混合经充分反应放热234 kJ
B. 若反应开始时加入催化剂, 则使E1 、E2 都变大
C. 正反应的活化能是134kJ/mol
D. 该反应的反应热⊿H = E2–E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 100 mL 0.1 mol·L-1 K2SO4溶液中,含有氧原子数为0.04NA
B. 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA
C. 25 ℃时,1.0 L pH=13的Ba(OH)2溶液中,含有的OH-数目为0.2NA
D. 100 g 17%的氨水中,含有氨分子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com