
【题目】【物质结构与性质】
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。
(1)基态E原子的价电子排布式为________________________;
(2)AB32-的立体构型是____________,其中A原子的杂化轨道类型是___________________________。
(3)A22-与B22+互为等电子体,B22+的电子式可表示为________________,1molB22+中含有的π键数目为________________________。
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键___________________。
(5)化合物DC2的晶胞结构如图所示,该离子化合协晶体的密度为ag/cm3,则晶胞的体积是_________________(只要求列算式,阿伏加德罗常数的值为NA)

【答案】(1)3d54s1
(2)平面三角形 sp2
(3)![]() 2NA
2NA
(4)F-H…F、F-H…O、O-H…F、O-H…O
(5)312/aNAcm3
【解析】A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,则A原子有2个电子层,最外层电子数为4,故A为碳元素;C在元素周期表的各元素中电负性最大,则C为氟元素;B原子基态时s电子数与P电子数相等,原子序数小于氟元素,处于第二周期,核外电子排布为1s22s22p4,则B为氧元素;D的基态原子核外有6个能级且全部充满电子,核外电子排布为1s22s22p63s23p64s2,则D为Ca元素;
E原子基态时未成对电子数是同周期元素中最多的,其原子外围电子排布为3d54s1,则E为Cr元素。
(1)E为Cr元素,基态原子的价电子排布式为3d54s1
(2)CO32-中C原子的价层电子对数为3+(4+22×3)/2=3,C原子孤对电子对数=(4+22×3)/2=0,CO32-为平面三角形,C原子采取sp2杂化
(3)C22-与O22+互为等电子体,离子结构相同,O22+的电子式可表示为![]() ,1mol O22+中含有的π键数目为2NA
,1mol O22+中含有的π键数目为2NA
(4)HF水溶液中存在的所有氢键为:F-H…F、F-H…O、O-H…F、O-H…O
(5)由化合物CaF2的晶胞结构可知,晶胞中含有钙离子数目为8×1/8++6×1/2=4
含有氟离子数目为8,故晶胞的质量为4×78g,该离子化合协晶体的密度为a g/cm3,则晶胞的体积=4×78/NA/ a g/cm3="312" /aNAcm3


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行如下实验。
I.实验探究

步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的氢气流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)组装好仪器后,要检查装置的气密性。简述检查虚线框内装置气密性的方法:________。
(2)B装置中所盛放的试剂是_____,其作用是_______。
(3)步骤3中的必要操作为打开K1、K2,_______(请按正确的顺序填入下列步骤的字母)。
A.加热至Na2O2逐渐熔化,反应一段时间
B.用小试管收集气体并检验其纯度
C.关闭K1
D.停止加热,充分冷却
(4)由上述实验可推出Na2O2与H2反应的化学方程式为__________。
II.数据处理
(5)实验结束后,该同学欲测定C装置硬质玻璃管内白色固体中未反应完的Na2O2含量。
其操作流程如下:
![]()
①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和____。
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数_____(填“偏大”“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”的锂—铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH一,下列说法不正确的是 ( )

A. 放电时,Li+透过固体电解质向Cu极移
B. 放电时,正极的电极反应式为O2+2H2O+4e一=4OH—
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 通空气时,整个反应过程中,铜相当于是催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4 制备路线如下:

查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡[Sn(OH)C1]。
回答下列问题:
(1)操作I的步骤为_____________________、过滤、洗涤、干燥。过滤后滤液仍混浊的原因是(除滤纸破损,所有仪器均洗涤干净)__________________________、__________________________.
(2)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式及化学反应原理解释原因:
_________________________________________________
(3)加入锡粉的作用有两个:①调节溶液pH;②_____________________。
(4)SnS04还可在酸性条件下用作双氧水的去除剂,发生反应的离子方程式是______________________________________。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取质量为m g的锡粉溶于稀硫酸中,向生成的SnSO4中加入过量的Fe2(SO4)3溶液,用物质的量浓度为c mol/L的K2Cr207标准溶液滴定生成的Fe2+,共用去K2Cr207溶液的体积为V L。 则锡粉中锡的质量分数是_______________。(Sn的摩尔质量为M g/mol,用含m、c、V、M的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍在金属羰基化合物(金属元素和CO中性分子形成的一类配合物)、金属储氢材料(能可逆地多次吸收、储存和释放H2的合金)等领域用途广泛。
(1)基态Ni原子核外电子排布式为__________________________。
(2)Ni(CO)4中镍元素的化合价为__________,写出与CO互为等电子体的带一个单位正电荷的阳离子为:_______。Ni(CO)4的一氯代物有2种,其空间构型为_______________ o
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构如图所示,则该晶体的化学式为_____________

(4)下列反应常用来检验Ni2+,请写出另一产物的化学式:_______________。

与Ni2+配位的N原子有__________个,该配合物中存在的化学键有_________(填序号)。
A.共价键 B.离子键 C.配位键 D.金属键 E.氢键
(5)Ni与Fe的构型相同(体心立方堆积),Ni的摩尔质量为M g/mol,阿伏加德罗常数为NA,密度为a g/cm3Ni原子的半径为_________pm(金属小球刚性相切)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定精度也越来越高,现有一种简单可行的测定方法,具体步骤为:
①将固体NaCl研细、干燥后,准确称取mgNaCl固体转移到定容仪器A中;
②用滴定管向A仪器中滴加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为Vcm3。
(1)步骤①中A仪器最好用__________。(填仪器名称)
(2)步骤②中用酸式滴定管好还是用碱式滴定管好__________,理由是__________________。
(3)能否用胶头滴管代替步骤②中的滴定管__________。理由是_________________________
(4)能否用水代替苯__________,理由是____________________
(5)已知NaCl晶体结构如图所示,用X射线测得NaCl晶体中靠得最近的Na+与Cl-间的平均距离为acm,则用上述测定方法测得的阿伏加德罗常数NA的表达式为NA=__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨气易溶于水生成氨水,氨水电离生成铵根离子,铵根离子中氮原子采取________杂化,NH4+中HNH键角比NH3中HNH键角大,原因是__________________。
(2)Cu3N形成的晶体结构如图所示,N3-的配位数是________________。

(3)常温常压下,给水施加一个弱电场便可形成冰,称之为“热冰”,热冰中微粒间存在的作用力有________,其大小顺序是__________。
(4)NaF和NaCl属于同一主族的钠盐,但NaF的莫氏硬度比NaCl大,原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖,其晶胞结构如图。

(1)根据图示晶胞结构,推算晶体中Y、Cu、Ba和O原子个数比,确定其化学式_________________。
(2)根据(1)所推出的化合物的组成,计算其中Cu原子的平均化合价(该化合物中各元素的化合价为![]() 、
、![]() 、
、![]() 和
和![]() ),试计算化合物中这两种价态Cu原子个数比___________。
),试计算化合物中这两种价态Cu原子个数比___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护环境,充分利用资源,可将工业废弃物转变成重要的化工原料。
请回答下列问题:
(1)可用NaClO3氧化酸性FeCl2废液得到FeCl3,FeCl3具有净水作用,但腐蚀设备。
①写出NaClO3氧化酸性FeCl2的离子方程式:__________________________。
②若酸性FeCl2废液中:c(Fe2+)=2.0×10-2 mol∕L,c(Fe3+)=1.0×10-3 mol∕L,c(Cl-)=5.3×10-2 mol∕L,则该溶液的pH约为_________。
③FeCl3净水的原理是:_________________(用离子方程式及适当文字回答);FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是_________(用离子方程式表示)。
(2)可用废铁屑为原料,按下图的工艺流程制备聚合硫酸铁(PFS),PFS是一种新型的
絮凝剂,处理污水比FeCl3高效,且腐蚀性小。
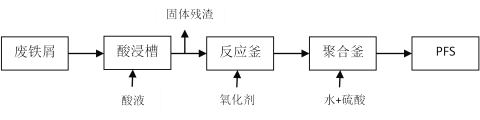
①酸浸时最合适的酸是______________。
②反应釜中加入的氧化剂,下列试剂中最合适的是____________(填标号)。
a.HNO3 b.KMnO4 c.Cl2 d.H2O2
检验其中Fe2+是否完全被氧化,应选择____________________(填标号)。
a.K3[Fe(CN)6]溶液 b.Na2SO3溶液 c.KSCN溶液
③生成PFS的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+欲使平衡正向移动可采用的方法是____________(填标号)。
a.加入NaHCO3 b.降温 c.加水稀释 d.加入NH4Cl
(3)废铁屑在一定条件下,可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe+2Li2S,维持电流强度为1A,a电池工作1小时,理论上消耗FeS2__________g。(已知1mol电子的电量为96500C)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com