
.(10分)下表是某超市出售的加碘食盐的有关说明:
|
配 料 表 |
精制盐、碘酸钾 |
|
含 碘 量 |
45±5mg/kg |
|
储 藏 方 法 |
通风、防潮 |
|
食 用 方 法 |
根据烹调所需适量加入 |
某研究性学习小组欲通过实验检验该碘盐中是否含碘:
(1)首先取该食盐样品配制室温下的饱和溶液:向200 mL蒸馏水中加入75.0g 该食盐样品,加热并搅拌,直到完全溶解。冷却至室温。(已知室温条件下氯化钠溶解度为36 g)
在加热过程中需要用到的仪器有铁架台、酒精灯、铁圈、____________、烧杯和玻璃棒。冷却至室温过程中若出现____________________(填现象),则证明其为饱和溶液。
(2)甲同学先向该饱和食盐溶液中加入1mol/L的KI溶液和几滴淀粉溶液,然后加入0.1mol/L稀硫酸,振荡,溶液变为蓝色。该实验发生的化学反应中氧化剂与还原剂的物质的量之比为_______________。请在下图中画出参加反应的IO3—的物质的量和析出的I2单质的物质的量的关系曲线。
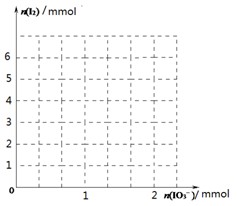
(3)乙同学认为甲同学的实验方案不严谨,他提出如下假设:空气中的氧气可能参与反应,使溶液变蓝。反应的离子方程式为:_____________________________________。请你设计实验方案验证乙同学的假设是否正确: 。
(10分)
(1)石棉网 固体析出(每空1分,共2分)
(2)1:5(2分)
 (2分)
(2分)
(3)O2+4I-+4H+=2I2+2H2O(2分)
向1mol/L的KI溶液中加入0.1 mol/L稀硫酸和几滴淀粉溶液,振荡,若溶液变为蓝色,则乙同学的假设正确。(2分)
【解析】(1)对于底面积较大的容器加热时要垫石棉网;
饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时所得的溶液;
(2)由IO3-+5I-+6H+=3I2+3H2O可知反应中氧化剂与还原剂的物质的量之比为1:5;
而IO3-与生成的I2的物质的量比为1:3
(3)I—还原性很强,在常温下即可被氧气氧化为碘。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
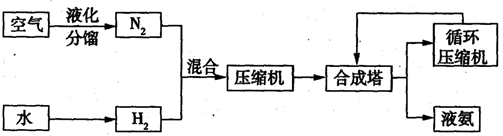
| 气体名称 | 氨气 | 氧气 | 氦气 | 氖气 | 氩气 | 氪气 | 氚气 |
| 沸点/℃ | -196 | -183 | -269 | -264 | -186 | -153 | -108 |
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J?t-1 | 28×109 | 38×109 | 48×109 |
| ||
| 高温 |
| ||
| 高温 |
| NH3含量% 压强/MPa 温度/℃ |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
 2NH3的△H
2NH3的△H| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
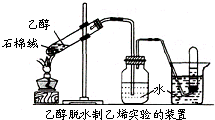 中新社2008年10月30日报道,在从日本进口的日式酱油、芥末酱中检测出了甲苯和乙酸乙酯.试回答下列问题:
中新社2008年10月30日报道,在从日本进口的日式酱油、芥末酱中检测出了甲苯和乙酸乙酯.试回答下列问题:| 催化剂 | ①浓硫酸 | ②石棉绒 (闪石) |
③P2O5 | ④浓硫酸 石棉绒 |
⑤P2O5 石棉绒 |
| KMnO4/H+褪色情况 | 褪色 | 几乎不褪色 | 褪色 | 褪色 | 褪色 |
| 加热产生气体的时间 | 45s | 50s | 35s | 47s | 38s |
| 反应温度 | 170℃ | 180℃ | 82℃ | 170℃ | 87℃ |
| 气体气流量 | 多 | 很少 | 多 | 较多 | 较多 |
| 反应液炭化情况 | 严重 | 无炭化 | 无炭化 | 严重 | 无炭化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)下表是某超市出售的加碘食盐的有关说明:
| 配 料 表 | 精制盐、碘酸钾 |
| 含 碘 量 | 45±5mg/kg |
| 储 藏 方 法 | 通风、防潮 |
| 食 用 方 法 | 根据烹调所需适量加入 |
某研究性学习小组欲通过实验检验该碘盐中是否含碘:
(1)首先取该食盐样品配制室温下的饱和溶液:向200mL蒸馏水中加入75.0g 该食盐样品,加热并搅拌,直到完全溶解。冷却至室温。(已知室温条件下氯化钠溶解度为36 g)
在加热过程中需要用到的仪器有铁架台、酒精灯、铁圈、____________、烧杯和玻璃棒。冷却至室温过程中若出现____________________(填现象),则证明其为饱和溶液。
(2)甲同学先向该饱和食盐溶液中加入1mol/L的KI溶液和几滴淀粉溶液,然后加入0.1mol/L稀硫酸,振荡,溶液变为蓝色。该实验发生的化学反应中氧化剂与还原剂的物质的量之比为_______________。请在下图中画出参加反应的IO3—的物质的量和析出的I2单质的物质的量的关系曲线。
(3)乙同学认为甲同学的实验方案不严谨,他提出如下假设:空气中的氧气可能参与反应,使溶液变蓝。反应的离子方程式为:_____________________________________。
请你设计实验方案验证乙同学的假设是否正确:
。
查看答案和解析>>
科目:高中化学 来源:2012届安徽省高二下学期期末联考化学试卷 题型:实验题
(10分)下表是某超市出售的加碘食盐的有关说明:
|
配 料 表 |
精制盐、碘酸钾 |
|
含 碘 量 |
45±5mg/kg |
|
储 藏 方 法 |
通风、防潮 |
|
食 用 方 法 |
根据烹调所需适量加入 |
某研究性学习小组欲通过实验检验该碘盐中是否含碘:
(1)首先取该食盐样品配制室温下的饱和溶液:向200 mL蒸馏水中加入75.0g 该食盐样品,加热并搅拌,直到完全溶解。冷却至室温。(已知室温条件下氯化钠溶解度为36 g)
在加热过程中需要用到的仪器有铁架台、酒精灯、铁圈、____________、烧杯和玻璃棒。冷却至室温过程中若出现____________________(填现象),则证明其为饱和溶液。
(2)甲同学先向该饱和食盐溶液中加入1mol/L的KI溶液和几滴淀粉溶液,然后加入0.1mol/L稀硫酸,振荡,溶液变为蓝色。该实验发生的化学反应中氧化剂与还原剂的物质的量之比为_______________。请在下图中画出参加反应的IO3—的物质的量和析出的I2单质的物质的量的关系曲线。
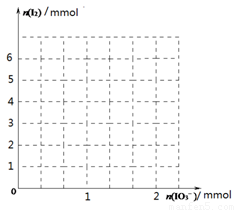
(3)乙同学认为甲同学的实验方案不严谨,他提出如下假设:空气中的氧气可能参与反应,使溶液变蓝。反应的离子方程式为:_____________________________________。
请你设计实验方案验证乙同学的假设是否正确:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com