
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列_____物质相似。
A 75%酒精 B 双氧水 C “84”消毒液(NaClO溶液)
(2)操作Ⅱ是根据KMnO4和K2CO3两物质在溶解度上的差异,采用_______(填操作步骤)、趁热过滤到KMnO4粗晶体的。
(3)铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:_______。
(4)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:_______。
(5)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得_____mol KMnO4。
【答案】BC 浓缩结晶 2Mn2++5NaBiO3+14H+=2MnO4+5Bi3++5Na++7H2O 2MnO2+4KOH+O2![]() 2K2MnO4+2H2O
2K2MnO4+2H2O ![]()
【解析】
二氧化锰与氢氧化钾在空气中熔融,加水溶解得到K2MnO4溶液,通入二氧化碳得到KMnO4、MnO2、K2CO3,过滤除去滤渣(MnO2),滤液为KMnO4、K2CO3溶液,浓缩结晶,趁热过滤得到KMnO4晶体,母液中含有K2CO3,在母液中加石灰乳(氢氧化钙)得到碳酸钙沉淀和KOH。
(1)KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,故选BC;
(2)操作Ⅱ是根据KMnO4和K2CO3两物质在溶解度上的差异,采用浓缩结晶、趁热过滤到KMnO4粗晶体的;
(3)铋酸钠(不溶于水)在酸性溶液中与Mn2+反应生成MnO4-和Bi3+,则反应的离子方程式为:2Mn2++5NaBiO3+14H+═2MnO4-+5Bi3++5Na++7H2O;
(4)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水。反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为 2MnO2+4KOH+O2![]() 2K2MnO4+2H2O;
2K2MnO4+2H2O;
(5)2MnO2+4KOH+O2![]() 2K2MnO4+2H2O,可知最初的原料中1mol MnO2恰好得到1mol K2MnO4.由3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2知,1mol K2MnO4在反应中能得到
2K2MnO4+2H2O,可知最初的原料中1mol MnO2恰好得到1mol K2MnO4.由3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2知,1mol K2MnO4在反应中能得到![]() mol KMnO4。
mol KMnO4。


科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,工业上由铬铁矿(主要成分为FeO·Cr2O3、SiO2等)制备,制备流程如图所示:
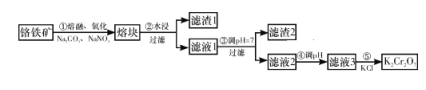
已知:
Ⅰ.步骤①的主要反应为2FeO·Cr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
Ⅱ.2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
下列说法正确的是( )
A. 步骤①熔融、氧化可以在陶瓷容器中进行
B. 步骤①中每生成44.8 L CO2共转移7 mol电子
C. 步骤④若调节滤液2的pH,使之变小,则有利于生成Cr2O72-
D. 步骤⑤生成K2Cr2O7晶体,说明该温度下K2Cr2O7的溶解度大于Na2Cr2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下图的能量变化,确定该反应的热化学方程式书写正确的是( )
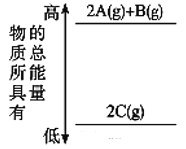
A. 2A(g)+B(g)=2C(g) ΔH<0
B. 2A(g)+B(g)=2C(g) ΔH>0
C. 2A+B=2C ΔH<0
D. 2C=2A+B ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作描述正确的是(必要的夹持装置及石棉网已省略)( )
A.装置①可用于实验室制乙烯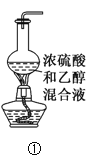
B.装置②可用于实验室制乙炔,并验证乙炔发生氧化反应
C.装置③可用于工业酒精制无水乙醇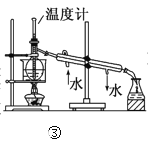
D.若A为醋酸,B为碳酸钙,C为苯酚钠溶液,装置④不能用来验证醋酸、碳酸和苯酚酸性的强弱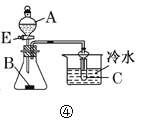
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验某溶液X中是否含有 Na+、K+、Fe3+、Mg2+、Iˉ、Cl-、CO32ˉ、SO42ˉ,限用的试剂有:盐酸、硫酸、硝酸银溶液、硝酸钡溶液。设计如下实验步骤,并记录相关现象。下列叙述不正确的是 ( )

A. 溶液X中一定含有Iˉ、CO32ˉ、SO42ˉ
B. 通过在黄色溶液中加入硝酸银溶液可以检验溶液X中是否存在Cl-
C. 试剂①为硝酸钡溶液
D. 通过焰色反应,可确认溶液X中阳离子的种类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
该兴趣小组设计了下列实验装置,进行实验。请回答下列问题:
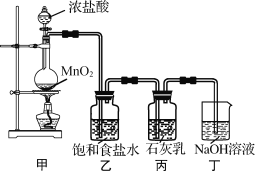
(1)①甲装置用于制备氯气,乙装置的作用是_________。
②实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法不正确的是__。(填字母)
A 若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1∶5
B 若产物为NaClO、NaCl,则吸收后的溶液中n(NaClO)=n(NaCl)
C 若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比为2∶1
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,其可能原因是部分氯气未与石灰乳反应而逸出,以及温度升高。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢匀速地通入足量氯气,得出了Ca(ClO)2、Ca(ClO3)2两种物质的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
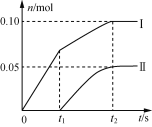
①图中曲线II表示____(填物质的化学式)的物质的量随反应时间变化的关系;
②所取石灰乳中含有Ca(OH)2的物质的量为____mol;
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进。请你给出一种改进方法____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于芳香族化合物A的有关信息如下:
①A中碳的质量分数为77.77%,H的质量分数为7.40%,其余为氧;
②光谱法测定时波谱图反映出A的相对分子质量为108;
③A可以与乙酸在浓硫酸加热条件下生成有水果香味的产物;
④A可以与金属钠反应放出氢气,但不能与氢氧化钠反应;试回答:
(1)测A的相对分子质量的光谱为____(填字母)。A苯环上的一溴代物有____种。
A.红外光谱 B.质谱 C.核磁共振谱
(2)A通常有三种不同类别的芳香族同分异构体,试写出另两种不同类别的同分异构体的结构简式(各写一种):____,____。
(3)写出③中反应的化学方程式:_____。
(4)A在铜丝催化作用下加热发生反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
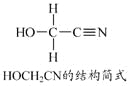
【题目】[物质结构与性质]
[Zn(CN)4]2–在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2–+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN
(1)Zn2+基态核外电子排布式为____________________。
(2)1 mol HCHO分子中含有σ键的数目为____________mol。
(3)HOCH2CN分子中碳原子轨道的杂化类型是______________。
(4)与H2O分子互为等电子体的阴离子为________________。
(5)[Zn(CN)4]2–中Zn2+与CN–的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2–的结构可用示意图表示为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时,要通入适量空气使部分甲烷燃烧,其目的是____________。已知25℃、101 kPa时,1 mol甲烷完全燃烧生成CO2和液态水时放出896 kJ热量,则甲烷的热值为___kJ·g-1。
(2)一定温度下,在偏铝酸亚铜(CuAlO2)的催化作用下,CH4与CO2转化成乙酸,可实现“CO2减排”,写出反应的化学方程式__________,其优点是_____(请写出一条)。
(3)甲烷可以消除氮氧化物污染。如: CH4(g)+2NO2(g)![]() N2(g) + CO2(g) + 2H2O(g)。
N2(g) + CO2(g) + 2H2O(g)。
①下列措施能够加快化学反应速率的是______。
a. 使用催化剂 b. 降低温度 c. 及时分离水
②若上述反应在恒容密闭容器中进行,则下列叙述能说明该反应达平衡的是_____。
a. 混合气体的质量不再变化
b. c(NO2) = 2c(N2)
c. 单位时间内生成1 mol CO2,同时生成2 mol NO2
(4)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:
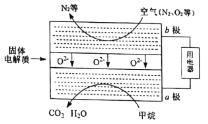
①b极电极反应式为_________。
②若燃料电池消耗的空气在标准状况下的体积是5.6L(假设空气中O2体积分数为20%),则理论上消耗甲烷____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com