
【题目】下列装置或操作描述正确的是(必要的夹持装置及石棉网已省略)( )
A.装置①可用于实验室制乙烯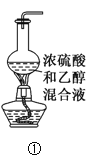
B.装置②可用于实验室制乙炔,并验证乙炔发生氧化反应
C.装置③可用于工业酒精制无水乙醇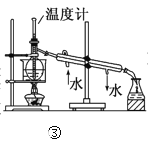
D.若A为醋酸,B为碳酸钙,C为苯酚钠溶液,装置④不能用来验证醋酸、碳酸和苯酚酸性的强弱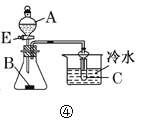
【答案】D
【解析】
A.实验室制乙烯,利用的是乙醇在浓硫酸的作用下于170℃发生的消去反应,因此反应装置中需要用到温度计,A项错误;
B.利用电石在实验室中制备乙炔时,由于电石与水反应十分剧烈,为控制反应速率,一般采用分液漏斗缓慢滴加食盐水的方法令二者反应;电石是块状固体,遇水后会变成粉末,因此图中采用多孔塑料板的方式无法有效阻隔电石,也就无法实现反应速率的控制;此外,利用电石与水反应制备的乙炔中含有PH3和H2S等还原性杂质,因此,在检验乙炔前,需要用硫酸铜溶液除去杂质,否则杂质会干扰乙炔的检验;
C.工业酒精是指乙醇含量大于等于95%的混合物,此时乙醇和水会形成共沸体系,蒸馏的方法无法将二者分离;因此通常采用在工业酒精中投入生石灰后,再进行蒸馏的方法获取无水乙醇,C项错误;
D.醋酸可以与碳酸钙反应生成CO2气体,可以证明醋酸的酸性强于碳酸;但由于醋酸具有挥发性,制备出的CO2中会必然含有醋酸杂质;醋酸酸性强于苯酚,能与苯酚钠反应生成苯酚,从而在较冷的溶液中引起浑浊现象;所以若不对CO2气体进行除杂,其中的醋酸杂质会产生干扰,故无法证明碳酸和苯酚酸性的强弱关系,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】将1molN2与3molH2混合充入2L的恒容密闭容器中,在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g)。经2min后测得NH3的物质的量为0.6mol。下列说法正确的是
2NH3(g)。经2min后测得NH3的物质的量为0.6mol。下列说法正确的是
A.反应速率v(NH3)=0.3mol/(L·min)B.2min时,c(N2)=0.7mol/L
C.2min时,H2的转化率为30%D.2min时,气体压强变为反应前的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氮是主要的大气污染物之一,工业上在一定条件下用NH3可将NO2还原。文宏同学在实验室对该反应进行了探究。实验设计如下(部分夹持装置省略):
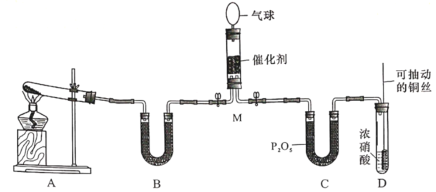
回答下列问题:
(1)用装置A制备NH3,其中发生反应的化学方程式为________________;装置B内的试剂是______________
(2)装置D中发生反应的离子方程式是_________________,铜丝可抽动的优点是________________。
(3)NH3和NO2在M中充分反应后,产生两种对环境友好的物质,该反应的化学方程式为________________,M中可观察到的现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况如图所示。下列说法正确的是( )
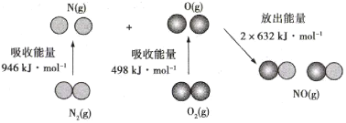
A.N2(g)和O2(g)反应生成NO(g)是放热反应B.2mol O(g)结合生成O2(g)时需要吸收498kJ能量
C.N2(g)+ O2(g)=2 NO(g) △H=+1444 kJ/molD.1mol NO(g)中的化学键断裂时需要吸收632kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2molL-1 降到 0.8molL-1 需要 20s,那么反应物浓度再由 0.8molL-1 降到 0.2molL-1 所需要的时间为
A.10sB.大于 10sC.小于 10sD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
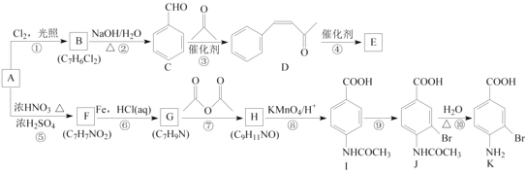
【题目】芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线(部分反应条件略去)如下图所示:
己知:①![]() ;
;
②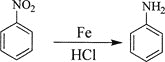
回答下列问题:
(1)A的名称是________,I含有官能团的名称是________。
(2)反应⑦的作用是________,⑩的反应类型是________。
(3)写出反应②的化学方程式:____________________________________________________。
(4)D分子中最多有________个原子共平面。E的结构简式为________。
(5)写出一种同时符合下列条件的F的同分异构体的结构简式:________。
①苯环上只有两种不同化学环境的氢原子;
②既能与银氨溶液反应又能与NaOH溶液反应。
(6)将由D为起始原料制备![]() 的合成路线补充完整。
的合成路线补充完整。
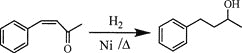 ________(无机试剂及溶剂任选)。
________(无机试剂及溶剂任选)。
合成路线流程图示例如下:
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列_____物质相似。
A 75%酒精 B 双氧水 C “84”消毒液(NaClO溶液)
(2)操作Ⅱ是根据KMnO4和K2CO3两物质在溶解度上的差异,采用_______(填操作步骤)、趁热过滤到KMnO4粗晶体的。
(3)铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:_______。
(4)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:_______。
(5)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得_____mol KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置有关说法错误的是

A. 装置Ⅰ:可以用来验证碳的非金属性比硅强
B. 装置Ⅱ:可以用来比较Na2CO3和NaHCO3的热稳定性
C. 装置Ⅲ:先从①口进气收集满二氧化碳,再从②口进气,可收集NO气体
D. 装置Ⅳ:制备Fe(OH)2并能保证较长时间观察到白色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铝粉与Fe3O4粉末配制成铝热剂,分成三等份。
①一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为V1;
②一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为V2;
③一份直接放入足量的盐酸中,充分反应后放出气体在标准状况下的体积为V3。
下列说法正确的是( )
A. V1=V3>V2 B. V2>V1=V3 C. V1=V2>V3 D. V1>V3>V2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com