
【题目】常温下,在20.0mL0.10molL-1氨水中滴入0.10molL-1的盐酸,溶液的pH与所加盐酸的体积关系如图。已知0.10molL-1氨水的电离度为1.32%,下列叙述错误的是( )

A. 该滴定过程应该选择甲基橙作为指示剂 B. M点对应的盐酸体积小于20.0mL
C. M点处的溶液中c(H+)=c(OH-) D. N点处的溶液中pH>12
【答案】D
【解析】
A.强酸弱碱相互滴定时,由于生成强酸弱碱盐使溶液显酸性,则应选择甲基橙作指示剂,故A叙述正确;
B.如果M点盐酸体积为20.0mL,则二者恰好完全反应生成氯化铵,氯化铵中铵根离子水解导致该点溶液应该呈酸性,要使溶液呈中性,则氨水应该稍微过量,所以盐酸体积小于20.0mL,故B叙述正确;
C.M处溶液呈中性,则存在c(H+)=c(OH-),故C叙述正确;
D.N点为氨水溶液,氨水浓度为0.10molL-1,该氨水电离度为1.32%,则该溶液中c(OH-)=0.10mol/L×1.32%=1.32×10-3mol/L,c(H+)=1014/1.32×103mol/L=7.6×10-12mol/L,所以该点溶液pH<12,故D叙述错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4的主要流程如下:
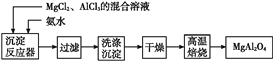
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式为_____________。
(2)判断流程中沉淀是否洗净所用的试剂是__________________。
(3)在25 ℃下,向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成______沉淀(填化学式),生成该沉淀的离子方程式:_____________。{已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34}。
(4)无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
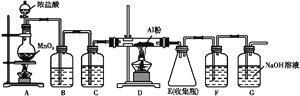
装置B中盛放饱和NaCl溶液,该装置的主要作用是______;F中试剂的作用是__________________________________________。
(5)将Mg、Cu组成的3.92 g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体1.792 L(标准状况),向反应后的溶液中加入4 mol·L-1的NaOH溶液80 mL时金属离子恰好完全沉淀。则形成沉淀的质量为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) △H<0,在恒容的密闭容器中,下列有关说法正确的是
2N2(g)+3H2O(g) △H<0,在恒容的密闭容器中,下列有关说法正确的是
A. 平衡时,其他条件不变,升高温度可使该反应的速率加快,平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1∶2时 ,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)常用于处理含硫废水。某学习小组在实验室中探究ClO2与Na2S的反应。
已知:① ClO2是极易溶于水的黄绿色气体,有毒,沸点为11℃。
② SO2 + NaClO3 + H2SO4→ ClO2 + NaHSO4(未配平)
③ ClO2 + NaOH→NaCl + NaClO3 + H2O(未配平)
请回答下列问题:
(1)设计如下装置制备ClO2

①装置A中反应的化学方程式为__________________________________。
②装置B中反应的氧化剂与还原剂的物质的量之比为___________。
③欲收集一定量的ClO2,选择上图中的装置,其连接顺序为a→g→h→_________________→d。
(2)探究ClO2与Na2S的反应
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物
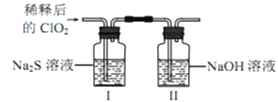
操作步骤 | 实验现象 | 结论 |
取少量Ⅰ中溶液放入试管甲中,滴加品红溶液和盐酸。 | 品红溶液始终不褪色 | ①无_______生成。 |
另取少量Ⅰ中溶液放入试管乙中,加入Ba(OH)2溶液和盐酸,振荡。 | ②___________ | 有SO42-生成 |
③继续在试管乙中加入Ba(OH)2溶液至过量,静置,取上层清液放入试管丙中,______________。 | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S反应的离子方程式为_________________________________________。用于处理含硫废水时,ClO2相对于Cl2的优点是_____________________________________________(任写一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如下图所示。下列说法正确的是( )
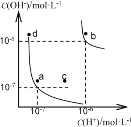
A. 图中对应点的温度关系为: a>b
B. 水的电离常数KW大小关系为:b>d
C. 温度不变,加入少量NaOH可使溶液从c点变到a点
D. b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一位同学用托盘天平称量2.5g药品,在称量中发现指针向左偏转,这时他应该( )
A.减少药品B.向右盘中加砝码
C.移动游码D.调节天平的平衡螺母
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某烃A的分子组成和结构,对这种烃进行以下实验:①取一定量的该烃,使其完全燃烧后的气体通过装有足量无水氯化钙的干燥管,干燥管增重7.2g;再通过足量石灰水,石灰水增重17.6g。②经测定,该烃(气体)在标准状况下的密度为1.25g·L-1。
I.现以A为主要原料合成某种具有水果香味的有机物,其合成路线如图所示。

(1)A分子中官能团的名称是______,E的结构简式为________。
(2)写出以下反应的化学方程式,并标明反应类型。反应③的化学方程式是__________; G是生活中常见的高分子材料,合成G的化学方程式是________________________;
Ⅱ.某同学用如图所示的实验装置制取少量乙酸乙酯,实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
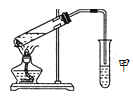
(1)实验开始时,试管甲中的导管不伸入液面下的原因是_______________;当观察到试管甲中________ 现象时认为反应基本完成。
(2)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。
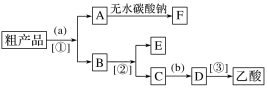
试剂b是____________;分离方法①是__________;分离方法③是________。
(3)在得到的A中加入无水碳酸钠粉末,振荡,目的是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com