
【题目】关于电解NaCl水溶液的说法正确的是 ( )

①电解产物为Cl2和Na
②电解过程中,碳棒一极产生黄绿色气体
③电解一段时间后,在碳棒附近的溶液中滴加酚酞溶液,溶液呈红色
④电解一段时间后,在铁钉附近的溶液中滴加酚酞溶液,溶液呈红色
A. ①③ B. ①④ C. ②③ D. ②④
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

(1)该反应是_____________(填“吸热”“放热”)反应。
(2)当反应达到平衡时,升高温度,A的转化率_____________ (填“增大”“减小”或“不变”),
(3)反应体系中加入催化剂对反应热是否有影响?_________________________。
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是: E1__________,E2-E1_____________ (填“增大”“减小”或“不变”)。
(5)在火箭推进器中装有肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量的气体,并放
出大量热。己知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。写出该反应的热化学方程式________________。
(6)N2H4可构成燃料电池,产物为无污染物质,写出在碱性环境下的负极电极反应式________________。
用该电池电解硫酸铜溶液(极棒都是石墨),电池中转移8mol电子,则硫酸铜溶液阳极产生的物质
为_________mol,该极电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3+5O2 ![]() 4NO+6H2O(g)在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是 ( )
4NO+6H2O(g)在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是 ( )
A. V(O2)=0.01mol ·L-1 ·s-1 B. V(NO)=0.008mol ·L-1 ·s-1
C. V(H2O)=0.015mol ·L-1 ·s-1 D. V(NH3)=0.002mol ·L-1 ·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是( )
A.在熔化和溶解时均不导电的化合物,叫做非电解质
B.电解质,非电解质都对化合物而言,单质不在此范畴
C.在水中的电解质一定都导电
D.水是极弱的电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块铝片加人某盐酸溶液中,铝片完全溶解,在所得溶液中继续滴加NaOH溶液。生成Al(OH)3的量与加人的NaOH溶液体积的变化关系如图所示,下列说法正确的是( )

A. 盐酸与铝片反应后,盐酸还有剩余
B. 图中B点之前发生的离子反应为Al3++3OH-===Al(OH)3↓
C. A→B段消耗的NaOH溶液体积与B→C段消耗的NaOH溶液体积比≥3∶1
D. 溶解铝片的盐酸浓度与滴加的NaOH溶液浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中![]() 的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
的含量变化来监测核电站是否发生放射性物质泄漏。下列有关![]() 的叙述中错误的是
的叙述中错误的是
A. ![]() 的化学性质与
的化学性质与![]() 相同 B.
相同 B. ![]() 的原子序数为53
的原子序数为53
C. ![]() 的原子核外电子数为78 D.
的原子核外电子数为78 D. ![]() 的原子核内中子数多于质子数
的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行氯气的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是

① | ② | ③ | ④ | |
A | 黄绿色 | 橙色 | 蓝色 | 无色 |
B | 无色 | 橙色 | 紫色 | 白色 |
C | 黄绿色 | 橙色 | 蓝色 | 白色 |
D | 黄绿色 | 无色 | 紫色 | 白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3 和MgSO4 的混合溶液中,滴加NaOH 溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中 Al2(SO4)3 与MgSO4 的物质的量浓度之比为( )
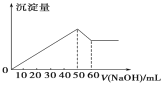
A. 1∶2 B. 2∶1 C. 6∶1 D. 3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
(1)工业上的湿法制备方法是用KClO与Fe(OH)3在KOH存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为____________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:

①操作(Ⅰ)的方法为_______________,隔绝空气减压干燥。
②检验产生X气体的方法是_____________。
③最终在溶液中得到K2FeO4晶体利用的原理是_____________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液;
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中;
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-;
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+;
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)溶液的体积,做3次平行实验,平均消耗30.00 mL的(NH4)2Fe(SO4)2溶液。
已知:滴定时发生的反应为:6Fe2++Cr2O72-+14H+==6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mL K2FeO4溶液加入到锥形瓶中所用的仪器是________。
②写出步骤3中发生反应的离子方程式________________________。
③步骤5中能否不加指示剂______(填“能”或“否”),原因是___________。
④根据上述实验数据,测定该样品中K2FeO4的质量分数为__________。
(4)配制0.1mol·L-1的K2FeO4,调节溶液pH,含铁离子在水溶液中的存在形态如图所示。下列说法正确的是_________(填字母)。

A.pH=2时,c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol·L-1
B.向pH=10的这种溶液中加硫酸铵,则HFeO4-的分布分数逐渐增大
C.向pH=1的溶液中加HI溶液,发生反应的离子方程式为:H2FeO4+H+==H3FeO4+
D.将K2FeO4晶体溶于水,水溶液呈弱碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com