
下列说法不正确的是
A.SiO2可与HF反应,因而氢氟酸不能保存在玻璃瓶中
B.SiO2可与水反应生成H2SiO3
C.向氯水中加CaCO3粉末,可提高溶液中HClO的浓度
D.向氯水中滴加蓝色石蕊试液先变红后褪色
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:2016届吉林省长春市高三上学期期中测试化学试卷(解析版) 题型:选择题
向100mL0.1mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是
A.a点时溶液中所含主要溶质为(NH4)2SO4
B.a→b段发生反应的离子方程式是: SO42-+Ba2+===BaSO4↓
C.b点为最大沉淀量,对应的纵坐标值为0.02
D.c点加入Ba(OH)2溶液的体积为200 mL
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南外国语学校高三上学期期中测试化学试卷(解析版) 题型:选择题
某酸溶液的pH=1,此酸溶液的物质的量浓度
A.0.1 mol·L-1
B.一定大于0.1 mol·L-1
C.若为强酸一定等于0.1 mol·L-1,若为弱酸一定大于0.1 mol·L-1
D.若为强酸一定≤0.1 mol·L-1,若为弱酸一定>0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南洛阳高级中学高二上9月月考化学试卷(解析版) 题型:实验题
(共18分)某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:
所用酸性KMnO4溶液的浓度可选择0.010 mol·L-1、 0.0010 mol·L-1, 催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol·L-1)的用量均为2 mL。
(1)已知草酸溶液中各种微粒存在形式的分布曲线图如下,请写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式 。
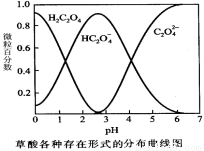
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T/K | 催化剂的用量 / g | 酸性KMnO4溶液的浓度/mol·L-1 | 实验目的 |
① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和 探究温度对反应速率的影响; c.实验①和 探究催化剂对反应速率的影响。 |
② | ||||
③ | 0.010 | |||
④ |
(3)某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验编号 | 溶液褪色所需时间 t / min | ||
第1次 | 第2次 | 第3次 | |
Ⅰ | 14.0 | 13.0 | 11.0 |
Ⅱ | 6.5 | 6.7 | 6.8 |
① 实验Ⅱ中用KMnO4的浓度变化来表示的平均反应速率为 (忽略混合前后溶液的体积变化)。
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,你认为是否正确 (填“是”或“否”)。他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行 (填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:
(4)该反应的催化剂选择MnCl2还是MnSO4并简述选择的理由:
(5)化学催化剂有很多,在生产和科技领域起到重大作用。探究小组又利用乙装置探究MnO2对H2O2分解的催化效果。将50 mL H2O2一次性加入盛有0.10 mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如下图所示。
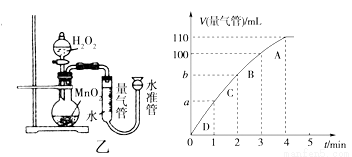
①实验时放出气体的总体积是____ ____mL。
②b______ __(填“大于”“小于”或“等于”)90 mL。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学高一上10月阶段测化学试卷(解析版) 题型:选择题
下列说法正确的是
A.1mol·L-1的氯化钠溶液是指此溶液中含有1molNaCl
B.从1L0.5mol·L-1的NaCl溶液中取出100mL溶液,其物质的量浓度变为0.1mol·L-1
C.摩尔质量指1mol物质的质量总和,以g为单位
D.以g·mol-1为单位时,在数值上摩尔质量与相对分子质量或相对原子质量相等
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期10月月考化学试卷(解析版) 题型:推断题
Ⅰ.A、B、C、D、E、F是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去):
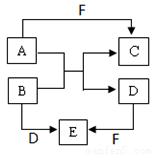
(1)若所有转化都是非氧化还原反应,B、D、E含有同种金属元素,F为强碱(部分产物略去)则B+D→E的离子方程式为________________,C为同周期元素构成的1:1型化合物,则C的电子式为___________________。
(2)若A、D、F为单质,B、C、E为化合物,B为两种非金属元素所组成的化合物,则E的化学式为___________,A+B→C+D的化学方程式为______________________。
Ⅱ.亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取来氯酸钠的工艺流程:
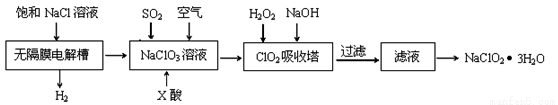
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用 ②ClO2气体在中性和碱性溶液中不能稳定存在。
(1)反应生成ClO2气体需要X酸酸化,X酸可以为_______________。
A.盐酸 B.稀硫酸 C.硝酸 D.H2C2O4溶液
(2)吸收塔内的温度不能过高的原因为__________________________。
(3)ClO2被S ClO2被S2-还原为ClO2-、Cl-转化率与pH关系如图。
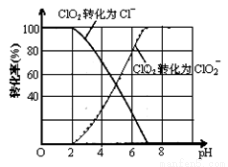
写出pH≤2时ClO2与S2- 反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷(解析版) 题型:选择题
下列关于平衡常数K的说法中,正确的是
A.在任何条件下,化学平衡常数是一个恒定值
B.改变反应物浓度或生成物浓度都会改变平衡常数
C.平衡常数K只与温度有关,与反应浓度、压强无关
D.从平衡常数K的大小不能推断一个反应进行的程度
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期10月调考理综化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列叙述错误的是
A.46 g NO2和N2O4混合气体中含有原子总数为3NA
B.常温常压下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应小于0.1NA
C.12 g金刚石中含有的共价键数为2NA
D.2.1 g DTO中所含中子数为NA
查看答案和解析>>
科目:高中化学 来源:2016届上海市高三上学期摸底测试化学试卷(解析版) 题型:选择题
某有机物的结构如图:它的同分异构体中属于芳香酸的有
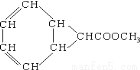
A.8种 B.10种 C.12种 D.14种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com