
某酸溶液的pH=1,此酸溶液的物质的量浓度
A.0.1 mol·L-1
B.一定大于0.1 mol·L-1
C.若为强酸一定等于0.1 mol·L-1,若为弱酸一定大于0.1 mol·L-1
D.若为强酸一定≤0.1 mol·L-1,若为弱酸一定>0.1 mol·L-1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016届江苏省高三上学期第三次月考化学试卷(解析版) 题型:实验题
某课外活动小组设计了以下实验验证Ag与浓硝酸反应的过程中可能产生NO,其实验流程图如下:

(1)测定硝酸的物质的量反应结束后,从如图装置B中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为__________________________mol,则Ag与浓硝酸反应过程中生成的NO2在标准状况下的体积为_________________________mL。
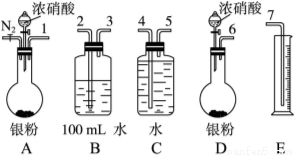
(2)测定NO的体积
①从如图所示的装置中,你认为应选用________装置进行Ag与浓硝酸反应实验,选用的理由是_______。
②选用如图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是______________(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置___________(填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中____________(填“有”或“没有”)NO产生,作此判断的依据是_____________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
为了除去KCl固体中少量MgSO4和CaCl2杂质,须进行下列六项操作,正确的次序是①加水溶解; ②加热蒸发得到晶体; ③加入过量BaCl2溶液; ④加入过量盐酸; ⑤加入过量的K2CO3 ⑥过滤
A.①⑤③⑥④② B.①⑤③④⑥②
C.①③④⑥⑤② D.①③⑤⑥④②
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃兰州一中高二上期中测试文科化学试卷(解析版) 题型:选择题
下列烷烃的命名中,正确的是
(A)3―甲基丁烷 (B)2―乙基丁烷
(C)2,3―二甲基丁烷 (D)3,4―二甲基丁烷
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三上学期第二次月考理综化学试卷(解析版) 题型:推断题
软质隐形眼镜材料W、树脂X的合成路线如图所示。
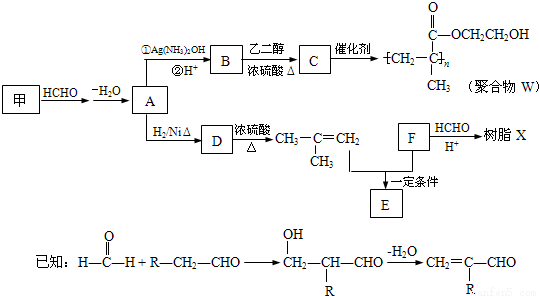
(1)A中含有的官能团名称是_______________。
(2)甲的结构简式是_______________。
(3)B→C反应的化学方程式是_______________。
(4)B有多种同分异构体.属于酯且含有碳碳双键的同分异构体共有______________种(不考虑顺反异构,下同),写出其中能发生银镜反应,且含有甲基的所有同分异构体的结构简式是___________________。
(5)已知F的相对分子质量为110,分子中碳原子、氢原子数都是氧原子数的3倍,苯环上的氢原子化学环境都相同.则F还能发生的反应是________________(填序号)
a.加成反应 b.氧化反应 c.加聚反应 d.水解反应
(6)写出树脂X可能的结构简式_______________(写出一种即可)。
(7)E的分子式为C10H14O2,含三个甲基,苯环上的一溴代物有两种,生成E的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南外国语学校高三上学期期中测试化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数。则下列叙述中,正确的是
A.32gS2-中电子数为2NA
B.46 gNO2和N2O4的混合物中含有的原子数为3NA
C.1 L 0.5 mol•L-1 Na2CO3溶液中含有的CO32-数为0.5NA
D.78 g Na2O2中阴离子数目为2NA
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上10月阶段质检化学试卷(解析版) 题型:填空题
(16分)目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应。平衡常数(K1、K2、K3)如下所示:
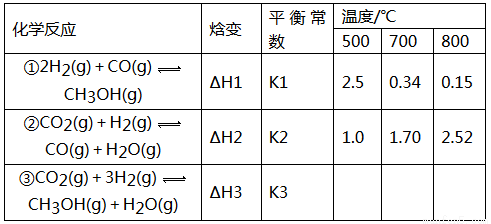
请回答下列问题:
(1)反应②是______________(填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=_____________(用K1、K2表示)。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有_______________(填字母序号)
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正____________v逆(填“>”、“=”或“<”).
(5)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它们在高温下能传导O2-离子,该电池的正极反应式为_________________。电池工作时,固体电解质里的O2-向_____________极移动。
(6)300℃时,在一定的压强下,5molCO与足量的H2在催化剂的作用下恰好完全反应变化的热量为454kJ。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
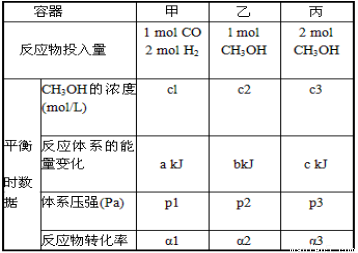
下列说法正确的是______________________。
A.2c1>c3 B.a+b<90.8 C.2p 2<p3 D.α1+α3<1
查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.SiO2可与HF反应,因而氢氟酸不能保存在玻璃瓶中
B.SiO2可与水反应生成H2SiO3
C.向氯水中加CaCO3粉末,可提高溶液中HClO的浓度
D.向氯水中滴加蓝色石蕊试液先变红后褪色
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期9月月考化学试卷(解析版) 题型:选择题
含NaOH 20.0g的稀溶液与足量的稀盐酸反应,放出28.7kJ的热量,表示该反应的热化学方程式是
A.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=+28.7kJ/mol
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-28.7kJ/mol
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=+57.4kJ/mol
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.4kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com