
| A. | 水晶和干冰的熔化 | B. | 食盐和醋酸钠的熔化 | ||
| C. | 乙醇和HCl溶于水 | D. | HCl和NaCl溶于水 |
分析 分子间作用力是分子之间存在一种把分子聚集在一起的作用力叫分子间作用力,又称范德华力,与物质的三态变化有关;
化学键是相邻原子之间强烈的相互作用,与物质的化学性质有关;
据此解答.
解答 解:A.水晶属于原子晶体熔化时断裂共价键,干冰熔化破坏分子间作用力,二者客服作用力不同,故A错误;
B.食盐熔化破坏离子键,醋酸钠的熔化破坏离子键,故B正确;
C.乙醇溶液水破坏分子间作用力,氯化氢溶液水电离生成氢离子与氯离子,破坏共价键,二者客服作用力不同,故C错误;
D.氯化氢溶于水断裂共价键,氯化钠溶于水断裂离子键,二者客服作用力不同,故D错误;
故选:B.
点评 本题考查了化学键与分子间作用力区别,明确二者概念是解题关键,注意分子间作用力只影响物质的物理性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
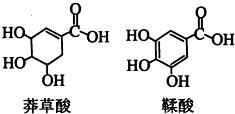 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )| A. | 两种酸都能与溴水反应且反应的原理相同 | |
| B. | 两种酸遇三氯化铁溶液都显色 | |
| C. | 鞣酸分子与莽草酸分子相比多了两个碳碳双键 | |
| D. | 等物质的量的两种酸与足量金属钠反应产生氢气的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
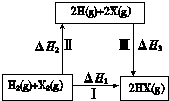
| A. | H2(g)+X2(g)=2H(g)+2X(g)△H>0 | |
| B. | 若X 分别表示Cl、Br、I,则过程Ⅱ吸收的热量依次减少 | |
| C. | 生成HX的反应热与途径有关,所以△H1≠△H2+△H3 | |
| D. | Cl2、Br2 分别发生反应Ⅰ,同一温度下的平衡常数分别为K1、K2,则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 氧化物 | 环境问题 | 主要来源 |
| A | CO2 | 破坏臭氧层 | 化石燃料的燃烧 |
| B | SO2 | 温室效应 | 汽车尾气的排放 |
| C | NO2 | 光化学烟雾 | 工厂废气的排放 |
| D | CO | 酸雨 | 汽车尾气和化石燃料的不完全燃烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
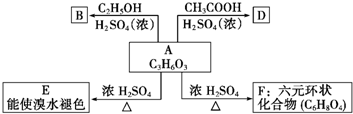
 A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.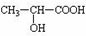 +CH3CH2OH $→_{△}^{浓硫酸}$
+CH3CH2OH $→_{△}^{浓硫酸}$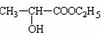 +H2O,
+H2O,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向10ml0.1mol/L的Ca(ClO)2的溶液中鼓入标态下的SO2气体44.8ml:Ca2++2ClO-+2H2O+2SO2=CaSO4↓+2Cl-+4H++SO42- | |
| B. | 向98.3%的浓硫酸中加入铜片并加热:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+2H2O+Cu2+ | |
| C. | 向NH4HCO3溶液中加足量浓NaOH溶液并加热:HCO3-+OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO32- | |
| D. | 用氯化铵和消石灰两种固体混合加热制氨气:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
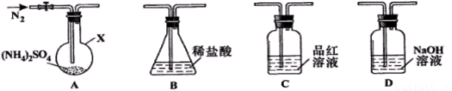
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com