
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,同种非金属形成非极性键,不同非金属形成极性键,以此来解答.
解答 解:①O2中只含非极性键;
②H2中只含非极性键;
③NH4NO3中含离子键和极性共价键;
④K2O2中含离子键和O-O非极性共价键;
⑤Ba(OH)2中含离子键和极性共价键;
⑥CH4中只含C-H极性共价键;
⑦CO2中只含C=O极性共价键;
⑧NaF只含离子键;
⑨NH3中只含N-H极性共价键;
⑩I2中只含非极性键,
(1)既有离子键又有非极性键的是④,故答案为:;
(2)既有离子键又有极性键的是③⑤,故答案为:③⑤;
(3)只含共价键的化合物为共价化合物,则属于共价化合物的是⑥⑦⑨,故答案为:⑥⑦⑨.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中化学键的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
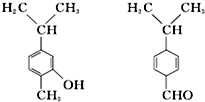
| A. | 是同分异构体 | |
| B. | 分子中共平面的碳原子数相同 | |
| C. | 可用红外光谱区分,但不能用核磁共振氢谱区分 | |
| D. | 前者能与溴水反应后者不能与溴水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0L1.0mo1•L-1的NaClO水溶液中含有的ClO-数为NA | |
| B. | 14g乙烯中含单键个数为2NA | |
| C. | 22.4LNO2中含分子数为NA个 | |
| D. | 1mol金属铁溶解于过量的氯化铁溶液中,电子转移数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
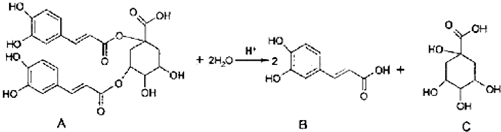
| A. | 1mol A和足量NaOH溶液反应,最多消耗11molNaOH | |
| B. | A在一定条件下能发生取代反应、加成反应和消去反应 | |
| C. | B能和浓溴水发生反应,1mol B最多消耗4molBr2 | |
| D. | C分子中含有手性碳原子. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
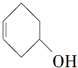 的叙述不正确的是( )
的叙述不正确的是( )| A. | 与HBr、溴水发生加成反应,产物都只有一种 | |
| B. | 分子式为C6H10O | |
| C. | 可发生加成、酯化和氧化反应 | |
| D. | 分子中有两种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水晶和干冰的熔化 | B. | 食盐和醋酸钠的熔化 | ||
| C. | 乙醇和HCl溶于水 | D. | HCl和NaCl溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )偶联可由下列两个途径制备有机化合物Ⅵ.
)偶联可由下列两个途径制备有机化合物Ⅵ.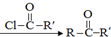
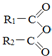 +H2O→R1-COOH+R2-COOH
+H2O→R1-COOH+R2-COOH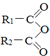

 .
. 、
、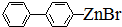 .
.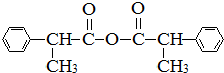 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.5mL 16mol•L-1浓硫酸与足量锌反应,转移电子数为0.2NA | |
| B. | 1.8gNH4+与2.3gNa+所含电子数目均为NA | |
| C. | 7.8 gNa2S固体和7.8 gNa2O2固体中含有的阴离子数目均为0.1 NA | |
| D. | 常温常压下,92 gNO2和N2O4混合气体含有的原子数为6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com