
【题目】写出下列反应的离子方程式
(1)一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4—(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4—:_____。
(2)硫酸酸化的硫酸亚铁溶液中加双氧水后溶液变为黄色:_____。
(3)KMnO4与盐酸反应生成MnCl2和Cl2:________。
(4)在碱性条件下,Cl2可将废水中的CN-氧化为无毒的CO2、N2:______。
(5)在酸性条件下,向含铬废水中加入FeSO4,可将Cr2O![]() 还原为Cr3+:_______。
还原为Cr3+:_______。
【答案】2Fe2++BH4-+4OH-=2Fe↓+2H2↑+B(OH)4- 2Fe2++H2O2+2H+=2Fe3+ +2H2O 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O 5Cl2+2CN-+8OH-=2CO2+N2+10Cl-+4H2O 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
【解析】
(1)一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,反应中只有Fe、H元素化合价发生变化,发生氧化还原反应,离子方程式为2Fe2++BH4-+4OH-=2Fe↓+2H2↑+B(OH)4-;
故答案是:2Fe2++BH4-+4OH-=2Fe↓+2H2↑+B(OH)4-;
(2)亚铁离子具有还原性,能够被双氧水氧化为铁离子,溶液显黄色,离子方程式为:2Fe2++H2O2+2H+=2Fe3+ +2H2O;
故答案是:2Fe2++H2O2+2H+=2Fe3+ +2H2O;
(3)KMnO4具有强氧化性,盐酸中Cl-具有还原性,被高锰酸钾氧化为氯气,KMnO4被还原为Mn2+,KMnO4与盐酸反应的离子方程式为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
故答案是:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(4)在碱性条件下,Cl2可将废水中的CN-氧化为无毒的CO2、N2,自身被还原为Cl-,根据电子守恒、电荷守恒及原子守恒可知发生反应的离子反应方程式为5Cl2+2CN-+8OH-=2CO2+N2+10Cl-+4H2O;
故答案是:5Cl2+2CN-+8OH-=2CO2+N2+10Cl-+4H2O;
(5)亚铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,二价铁离子被氧化成三价铁离子,Cr2O72-被还原为Cr3+,反应方程式为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
故答案是:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol/LNaOH溶液分别滴定20.00mL浓度均为0.10mol/LCH3COOH溶液和HCN溶液,所得滴定曲线如右图所示。下列说法错误的是

A. 点①和点②所示溶液中:c(CH3COO-)>c(CN-)
B. 点③和点④所示溶液中水的电离程度:③>④
C. 点①和点②所示溶液中:c(CH3 COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D. 相同条件,浓度均为0.10mol/L CH3COOH溶液和HCN溶液的导电性:CH3COOH>HCN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列电化学装置说法正确的是

A. 装置①中,构成电解池时Fe极质量既可增也可减
B. 装置②工作一段时间后,a极附近溶液的pH减小
C. 用装置③精炼铜时,d极为精铜
D. 装置④中电子由Fe经导线流向Zn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2。
②氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O
5Cl-+ClO3-+3H2O
该兴趣小组设计了下列实验装置,进行实验。

请回答下列问题:
(1)①甲装置用于制备氯气,乙装置的作用是____________________。
②该兴趣小组用100mL 12mol/L盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2____________g。
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,部分氯气未与石灰乳反应而逸出,以及温度升高是可能原因。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢、匀速地通入足量氯气,得出了![]() 、
、![]() 两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。

①图中曲线I表示_____________离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为______________mol。
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中![]() 的物质的量为0.37mol,则产物中
的物质的量为0.37mol,则产物中![]() =______________。
=______________。
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进。请你给出一种改进方法:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物的反应机理,对于消除其对环境的污染有重要意义。
(1)升高温度,绝大多数的化学反应速率增大,但是2NO(g)+O2(g) ![]() 2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g)
2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
I.2NO(g) ![]() N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
Ⅱ.N2O2(g)+O2(g) ![]() 2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
请回答下列问题:
①反应2NO(g)+O2(g) ![]() 2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
②决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
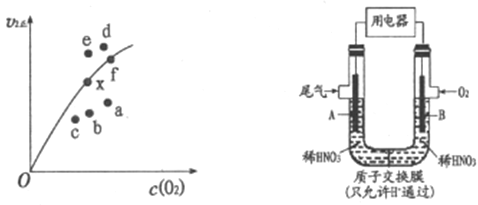
(2)通过图所示装置,可将汽车尾气中的NO、NO2转化为重要的化工原料HNO3,其中A、B为多孔惰性电极。该装置的负极是__________ (填“A”或“B”),B电极的电极反应式为__________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液甲,溶液乙为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c (NO2-)和c(CH3COO-)由大到小的顺序为__________(已知HNO2的电离常数Kα=7.1×10-4mol/L,CH3COOH的电离常数Kα=1.7×10-5mol/L)。可使溶液甲和溶液乙的pH相等的方法是__________。
a.向溶液甲中加适量水 b.向溶液甲中加适量NaOH
c.向溶液乙中加适量水 d.向溶液乙中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠( NaAlH4)是有机合成的重要还原剂。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝氢化钠的一种工艺流程如下图所示:

注:SiO2在“碱溶”时转化为铝硅酸钠(Na2Al2SixO8)沉淀。
(1)铝硅酸钠(Na2 Al2SixO4)可以用氧化物的形式表示其组成,形式为_______。
(2)“过滤I”中滤渣的主要成分有_______(填名称)。向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,发生反应的离子方程式为OH-+HCO3—===CO32—+H2O、__________________________。
(3)“电解I”的另一产物在1000℃时可与N2反应制备AIN,在这种产物中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,其原理如图所示。
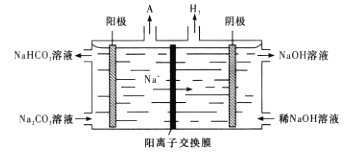
阳极的电极反应式为____________。已知F=96500C/mol,当I=0.5A时,通电80min,理论上阴极获得H2(标准状况下)的体积为_____L(结果保留两位有效数字)。
(5)铝氢化钠遇水发生剧烈反应,且反应产生大量气泡,其反应的化学方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】屠呦呦率领团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素。研究发现青蒿素中的某个基团对热不稳定,该基团还能与NaI作用生成I2。下列分析不正确的是

A. 推测青蒿素在乙醚中的溶解度小于在水中的溶解度
B. 通过元素分析与质谱法可确认青蒿素的分子式
C. 青蒿素中含有的 “![]() ” 基团是酯基
” 基团是酯基
D. 青蒿素中对热不稳定且具有氧化性的基团是“—O—O—”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家开发出一种低成本光伏材料——蜂窝状石墨烯。生产原理是:Na2O+2CO![]() Na2CO3+C(石量烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
Na2CO3+C(石量烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
A. 该生产石墨烯的反应属于氧化还原反应
B. 石墨烯与金刚石互为同素异形体
C. Na2O属于碱性氧化物,CO属于酸性氧化物,Na2CO3属于盐
D. 自然界中碳元素有游离态和化合态两种存在形式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com