
【题目】研究氮氧化物的反应机理,对于消除其对环境的污染有重要意义。
(1)升高温度,绝大多数的化学反应速率增大,但是2NO(g)+O2(g) ![]() 2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g)
2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
I.2NO(g) ![]() N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
Ⅱ.N2O2(g)+O2(g) ![]() 2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
请回答下列问题:
①反应2NO(g)+O2(g) ![]() 2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
②决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
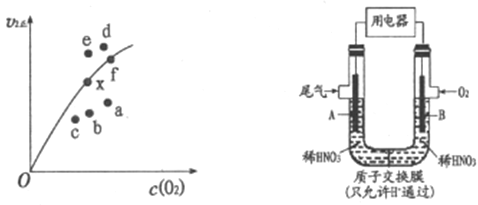
(2)通过图所示装置,可将汽车尾气中的NO、NO2转化为重要的化工原料HNO3,其中A、B为多孔惰性电极。该装置的负极是__________ (填“A”或“B”),B电极的电极反应式为__________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液甲,溶液乙为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c (NO2-)和c(CH3COO-)由大到小的顺序为__________(已知HNO2的电离常数Kα=7.1×10-4mol/L,CH3COOH的电离常数Kα=1.7×10-5mol/L)。可使溶液甲和溶液乙的pH相等的方法是__________。
a.向溶液甲中加适量水 b.向溶液甲中加适量NaOH
c.向溶液乙中加适量水 d.向溶液乙中加适量NaOH
【答案】△H1+△H2 ![]() 减小 < a A O2+4e-+4H+=2H2O c(NO3-)>c(NO2-)>c(CH3COO-) bc
减小 < a A O2+4e-+4H+=2H2O c(NO3-)>c(NO2-)>c(CH3COO-) bc
【解析】
(1)①运用盖斯定律,将方程式叠加,就可以得到相应反应的热化学方程式;根据反应达到平衡时正、逆反应速率相等,结合速率与物质浓度关系,可得K的表达式;再利用温度对化学平衡的影响,分析温度与化学平衡常数的关系;②根据活化能高反应速率慢,活化能低化学反应速率快,比较二者活化能的大小;然后利用温度对化学平衡移动的影响,结合物质浓度的变化,确定物质的位置;(2)根据负极失去电子,发生氧化反应物质所含元素的化合价升高;正极得到电子,发生还原反应进行分析判断;(3)利用物质之间的反应,确定溶液的成分,结合元素守恒、结合盐的水解规律比较离子浓度的大小;并根据影响溶液pH的因素选择合适的方法,调节溶液的pH,据此解答。
(1) I .2NO(g)![]() N2O2(g) △H1<0;II.N2O2(g)+O2(g)
N2O2(g) △H1<0;II.N2O2(g)+O2(g)![]() 2NO2(g) △H2<0,I+II可得:2NO(g) +O2(g)
2NO2(g) △H2<0,I+II可得:2NO(g) +O2(g)![]() 2NO2(g) △H=△H1+△H2,当该反应达到平衡时,V1正=V1逆,V2正=V2逆,所以V1正×V2正=V1逆×V2逆,即k1正c2(NO)×K2正c(N2O2)×c(O2)= k1逆c(N2O2)×K2逆c2(NO2)×c(O2),则是K=
2NO2(g) △H=△H1+△H2,当该反应达到平衡时,V1正=V1逆,V2正=V2逆,所以V1正×V2正=V1逆×V2逆,即k1正c2(NO)×K2正c(N2O2)×c(O2)= k1逆c(N2O2)×K2逆c2(NO2)×c(O2),则是K=![]() =
=![]() ;由于该反应的正反应为放热反应,所以升高温度,平衡向吸热的逆反应方向移动,使化学反应平衡常数减小;②2NO(g) +O2(g)
;由于该反应的正反应为放热反应,所以升高温度,平衡向吸热的逆反应方向移动,使化学反应平衡常数减小;②2NO(g) +O2(g)![]() 2NO2(g)反应的快慢由反应速率慢的反应II决定,所以反应的活化能E1<E2,温度升高,K2正增大,反应速率加快,c(NO2)减小,导致两者的积减小;V2正升高到某一温度时V2正减小,平衡向逆反应方向移动,c(O2)增大,因此反应重新达到平衡,则变为相应的点为a;
2NO2(g)反应的快慢由反应速率慢的反应II决定,所以反应的活化能E1<E2,温度升高,K2正增大,反应速率加快,c(NO2)减小,导致两者的积减小;V2正升高到某一温度时V2正减小,平衡向逆反应方向移动,c(O2)增大,因此反应重新达到平衡,则变为相应的点为a;
(2)A电极通入NO、NO2,N元素的化合价升高,失去电子,发生氧化反应产生HNO3,因此该电极为负极,通入O2的电极为正极,获得电子,发生还原反应,由于是酸性环境,所以该电极的反应式为O2+4e-+4H+=2H2O;
(3)实验室可用NaOH溶液吸收NO2,反应方程式为2NO2+2NaOH=NaNO3+NaNO2+H2O。若NaOH、NO2的物质的量都是0.2 mol,则根据反应方程式可知会产生0.1mol NaNO3和0.1molNaNO2;由于溶液的体积是1L,c(NO2-)=0.1mol/L,c(NO3-)=0.1mol/L 。NaNO3是强酸强碱盐,不水解,则c(NO3-)=0.1mol/L;而NaNO2是强碱弱酸盐,NO2-发生水解反应而消耗,所以c(NO2-)<0.1mol/L;溶液乙为0.1mol/L的CH3COONa,该盐是强碱弱酸盐,CH3COO-水解消耗,因此n(CH3COO-)<0.1mol;根据HNO2、CH3COOH的电离平衡常数可知酸性:HNO2>CH3COOH,所以水解程度:CH3COO->NO2-,因此等浓度的CH3COONa、NaNO2中离子浓度c(CH3COO-)< c(NO2-),故三种离子浓度由大到小的顺序是:c(NO3-)>c(NO2-)>c(CH3COO-);溶液甲是NaNO3和NaNO2的混合溶液,NaNO2水解使溶液显碱性,溶液乙为CH3COONa溶液,水溶液显碱性,由于CH3COONa水解程度大于NaNO2,所以碱性乙>甲,要使溶液甲和溶液乙的pH相等,可采用向甲溶液中加入适量的碱NaOH,使溶液的pH增大,也可以向乙溶液中加入适量的水进行稀释,使乙的pH减小,故合理选项是bc。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种制备高效漂白剂NaClO2的实验流程如图所示,反应I中发生的反应为3NaClO3+4SO2+3H2O====2ClO2+Na2SO4+3H2SO4+NaCl,下列说法中正确的是

A. 反应Ⅱ中H2O2做还原剂
B. 产品中含有SO42-、Cl-
C. NaClO2的漂白原理与SO2相同
D. 实验室进行结晶操作通常在坩埚中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向10mL0.1mol/L的HR溶液中逐滴加入0.1mol/L的氨水,所得溶液pH及导电性变化如图。下列分析正确的是

A. a~c点,溶液中离子数目先增大后减小
B. b点溶液pH=7说明c(NH4+)=c(R-)
C. c点溶液存在c(NH4+)>c(R-)>c(H+)>c(OH-)
D. b、c两点对应溶液中,水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中繁衍着无数水生生物,海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

(1)步骤①的实验操作名称是________;
(2)现有烧杯、玻璃棒以及必要的夹持仪器、物品。完成步骤①的实验尚缺少的玻璃仪器是_________________,步骤③中的萃取剂可选择________________
(3)步骤②中反应的离子方程式是______________________________;
(4)请设计一种简单的实验方法,检验提取碘后的水溶液中是否还含有单质碘:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生反应NO2(g)+SO2(g)![]() SO3(g)+NO(g),下列能说明反应达到平衡状态的是
SO3(g)+NO(g),下列能说明反应达到平衡状态的是
A. 体系压强保持不变B. 混合气体颜色保持不变
C. 混合气体的密度保持不变D. 每消耗1 mol SO3的同时生成1 molNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+2 H2SO4![]() 2PbSO4+2H2O,请完成下列问题:
2PbSO4+2H2O,请完成下列问题:
(1)放电时:正极的电极反应式是____________________;电解液中H2SO4的浓度将变_______(填“大”或者“小”);当外电路通过1 mol电子时,理论上负极板的质量增加_________________g。
(2)在完全放电耗尽PbO2和Pb时,若按如下图1连接,充电一段时间后,则在A电极上生成__________、B电极上生成__________,这种充电连接方式是否正确?_______(填“是”或者“否”)
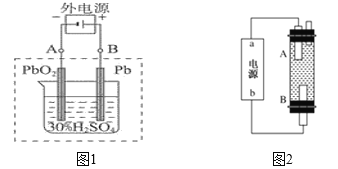
(3)某同学设计利用电解法制取漂白液或Fe(OH)2的实验装置如上图2所示。若通过电解饱和食盐水来制漂白液,则b为电源的_____极,该装置中发生的总反应方程式为_____________________
若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用_____________材料作电极。
II.已知一种锌铁电池的反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时,正极反应式为_______________________
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时,正极反应式为_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3的催化氧化是工业制取硝酸的关键步骤之一,该反应的化学方程式为:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),△H<0。
4NO(g)+6H2O(g),△H<0。
请回答下列问题:
(1)在恒温恒容下判断该反应达到平衡状态的标志是______(填字母)。
a.NH3和NO浓度相等 b.NO百分含量保持不变
c.容器中气体的压强不变 d.NH3的生成速率与NO的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3平衡转化率的是_____________。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.降低温度
(3)将0.050 mol NH3 (g)和0.060 mol O2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(NO)=0.040 mol/L。计算该条件下反应的NH3的转化率。平衡时,NH3的转化率α(NH3 )=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应C(s)+H2O(g)![]() CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )
CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )
①增加C的物质的量 ②保持体积不变,充入N2使体系压强增大 ③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
A. ①② B. ②③ C. ①④ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com