
【题目】常温下向10mL0.1mol/L的HR溶液中逐滴加入0.1mol/L的氨水,所得溶液pH及导电性变化如图。下列分析正确的是

A. a~c点,溶液中离子数目先增大后减小
B. b点溶液pH=7说明c(NH4+)=c(R-)
C. c点溶液存在c(NH4+)>c(R-)>c(H+)>c(OH-)
D. b、c两点对应溶液中,水的电离程度相同
【答案】B
【解析】
A.根据溶液的导电性与自由移动的离子浓度有关,与离子数目无关;B.根据电荷守恒分析判断;C.根据溶液的pH判断离子浓度关系;D.根据酸、碱抑制水的电离,含有弱酸根离子的盐会促进水的电离分析解答。
A.根据图象可知a~b点,溶液的导能力增强,b~c点溶液的导电能力减弱,说明从a~c点,溶液中自由移动的离子浓度先增大后减小,但是,离子数目在整个过程中一直在增大,A错误;
B.根据图象可知b点溶液的pH=7,c(H+)=c(OH-),结合电荷守恒c(H+)+ c(NH4+)=c(R-)+ c(OH-),可得c(NH4+)=c(R-),B正确;
C.根据图象可知c点溶液的pH>7,说明 c点溶液中离子浓度:c(OH-)>c(H+),C错误;
D.由曲线的起点的pH可知,HR为弱酸,b点溶液的pH=7、溶液的导电性最强,两者恰好完全反应生成弱酸弱碱盐,该盐水解促进水的电离;而c点溶液显碱性,说明氨水过量,氨水电离产生OH-会抑制水的电离,使水的电离程度减小,所以水的电离程度:b>c,D错误。
因此本题合理选项是B。


科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2;控制pH是为了使Al3+转化为A1(OH)3进入固体2
C. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
D. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,向10mL浓度均为0.1mol·L-1的NaOH和Na2CO3混合溶液中滴0.1mol·L-1的盐酸,溶液pH随盐酸加入体积的变化如图所示。下列说法正确的是

A. 在a点的溶液中,c(Na+)>c(CO32-)>c(Cl-)>c(OH-)>c(H+)
B. 在b点的溶液中,2n(CO32-)+n(HCO3-)<0.001mol
C. 在c点的溶液pH<7,是因为此时HCO3-的电离能力大于其水解能力
D. 若将0.1mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某充电宝锂离子电池的总反应为:xLi + Li1-xMn2O4![]() LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH
LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH![]() M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:
M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:

A. 锂离子电池放电时Li+向正极迁移
B. 镍氢电池放电时,正极电极反应式:NiOOH+H2O +e-==Ni(OH)2+OH-
C. 上图表示用锂离子电池给镍氢电池充电
D. 锂离子电池充电时,阴极的电极反应式: LiMn2O4—xe-== Li1-xMn2O4+ xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是
A.氢氧化镁中滴加盐酸:H++OH-=H2O
B.碳酸氢钙溶液中加入氢氧化钠溶液:HCO3-+OH-=CO32-+H2O
C.金属铝溶于氢氧化钠溶液:2Al +2OH-+6H2O=2[Al(OH)4]-+3H2↑
D.用FeCl3溶液腐蚀铜电路板:Fe3++Cu=Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化材料具有高硬度、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
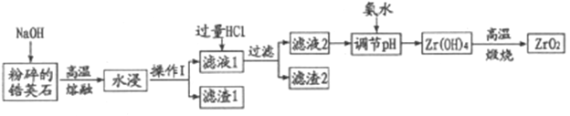
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有___________。
(2)操作I的名称是___________滤渣2的成分为___________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:___________。
(4)“调节pH”时,合适的pH范围是___________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是___________。
(5)写出“高温煅烧”过程的化学方程式___________。根据ZrO2的性质,推测其两种用途___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物的反应机理,对于消除其对环境的污染有重要意义。
(1)升高温度,绝大多数的化学反应速率增大,但是2NO(g)+O2(g) ![]() 2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g)
2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
I.2NO(g) ![]() N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
Ⅱ.N2O2(g)+O2(g) ![]() 2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
请回答下列问题:
①反应2NO(g)+O2(g) ![]() 2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
②决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
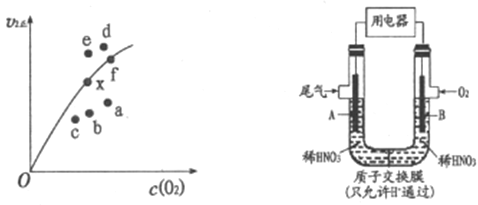
(2)通过图所示装置,可将汽车尾气中的NO、NO2转化为重要的化工原料HNO3,其中A、B为多孔惰性电极。该装置的负极是__________ (填“A”或“B”),B电极的电极反应式为__________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液甲,溶液乙为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c (NO2-)和c(CH3COO-)由大到小的顺序为__________(已知HNO2的电离常数Kα=7.1×10-4mol/L,CH3COOH的电离常数Kα=1.7×10-5mol/L)。可使溶液甲和溶液乙的pH相等的方法是__________。
a.向溶液甲中加适量水 b.向溶液甲中加适量NaOH
c.向溶液乙中加适量水 d.向溶液乙中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染物氟利昂—12的分子式是CF2Cl2,它是一种卤代烃,关于氟利昂—12的说法错误的是( )
A.它有两种同分异构体
B.化学性质虽稳定,但在紫外线照射下,可发生分解,产生的氯原子可引发损耗 O3的反应
C.大多数无色
D.它可看作甲烷分子的氢原子被氟、氯原子取代后的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵,析出晶体的化学式为( NH4)2Fe(SO4)2·6H2O。该物质可以溶于水而不溶于乙醇,是一种复盐,在空气中比一般亚铁盐稳定,常被用作氧化还原滴定的基准物。下面是某实验小组制取硫酸亚铁铵的部分装置与实验步骤:
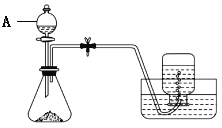
①称取约5 g铁屑放入锥形瓶中,加入15 mL 10% Na2CO3溶液,小火加热10分钟,倒掉剩余的碱液后,用蒸馏水洗净铁屑,干燥。
②称取2.24 g 铁屑放入锥形瓶中,由分液漏斗滴加20 mL 3 mol/L硫酸溶液。
③待反应结束后,由分液漏斗加入适量的(NH4)2SO4溶液,并将上述混合溶液转移至蒸发皿中,缓慢加热,浓缩至表面出现晶膜为止。
④放置冷却,析出晶体,过滤、用无水乙醇洗涤、干燥。
请回答下列问题:
(1)仪器A的名称是___________。
(2)实验开始前,检查反应装置气密性的方法为_______________________________。
(3)步骤①中小火加热的作用是________________________。
(4)步骤②中滴加硫酸溶液时留取少许溶液于分液漏斗中的原因是___________________。
(5)步骤③中理论上需加入2 mol/L (NH4)2SO4溶液______________mL。
(6)无水乙醇洗涤晶体的作用是_______________________________。
(7)取1.00 g高锰酸钾样品,再加入硫酸酸化,并配成250 mL溶液。取出25.00 mL,用浓度为0.1000 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,终点时用去标准液20.00 mL。则滴定时发生反应的离子方程式为_____,该样品中高锰酸钾的质量分数为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com