
【题目】下列化学反应的离子方程式正确的是
A.氢氧化镁中滴加盐酸:H++OH-=H2O
B.碳酸氢钙溶液中加入氢氧化钠溶液:HCO3-+OH-=CO32-+H2O
C.金属铝溶于氢氧化钠溶液:2Al +2OH-+6H2O=2[Al(OH)4]-+3H2↑
D.用FeCl3溶液腐蚀铜电路板:Fe3++Cu=Fe2++Cu2+
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种粒子。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是

A. 反应后溶液的酸性明显增强
B. 消耗1 mol还原剂,转移6 mol电子
C. 该反应的还原剂是Cl-
D. 氧化剂与还原剂的物质的量之比为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种制备高效漂白剂NaClO2的实验流程如图所示,反应I中发生的反应为3NaClO3+4SO2+3H2O====2ClO2+Na2SO4+3H2SO4+NaCl,下列说法中正确的是

A. 反应Ⅱ中H2O2做还原剂
B. 产品中含有SO42-、Cl-
C. NaClO2的漂白原理与SO2相同
D. 实验室进行结晶操作通常在坩埚中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,溶液M中存在的离子有A2- HA- H+ OH-等,存在的分子有H2O 、H2A 。根据题意回答下列问题:
(1)写出酸H2A的电离方程式:__________________________________________
(2)若溶液M由10mL 2mol.L-1NaHA溶液与10mL 2mol.L-1NaOH溶液混合而得,则溶液M中离子浓度由大到小的顺序为_____________________。已知常温下,Ksp(BaA)=1.8×10-10,向该混合溶液中加入10mL 1mol.L-1BaCl2溶液,混合后溶液中的C(Ba2+)为__________mol.L-1。
(3)若NaHA溶液呈碱性,则溶液M有下列三种情况:①0.01 mol.L-1的H2A溶液;②0.01 mol.L-1的NaHA溶液;③0.02 mol.L-1的HCl溶液与0.04 mol.L-1的NaHA溶液等体积混合而成。则三种情况的溶液中C(H2A)最大的为__________(填序号,下同);pH由大到小的顺序为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向10mL0.1mol/L的HR溶液中逐滴加入0.1mol/L的氨水,所得溶液pH及导电性变化如图。下列分析正确的是

A. a~c点,溶液中离子数目先增大后减小
B. b点溶液pH=7说明c(NH4+)=c(R-)
C. c点溶液存在c(NH4+)>c(R-)>c(H+)>c(OH-)
D. b、c两点对应溶液中,水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中繁衍着无数水生生物,海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

(1)步骤①的实验操作名称是________;
(2)现有烧杯、玻璃棒以及必要的夹持仪器、物品。完成步骤①的实验尚缺少的玻璃仪器是_________________,步骤③中的萃取剂可选择________________
(3)步骤②中反应的离子方程式是______________________________;
(4)请设计一种简单的实验方法,检验提取碘后的水溶液中是否还含有单质碘:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+2 H2SO4![]() 2PbSO4+2H2O,请完成下列问题:
2PbSO4+2H2O,请完成下列问题:
(1)放电时:正极的电极反应式是____________________;电解液中H2SO4的浓度将变_______(填“大”或者“小”);当外电路通过1 mol电子时,理论上负极板的质量增加_________________g。
(2)在完全放电耗尽PbO2和Pb时,若按如下图1连接,充电一段时间后,则在A电极上生成__________、B电极上生成__________,这种充电连接方式是否正确?_______(填“是”或者“否”)
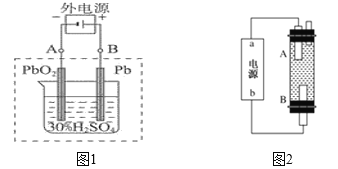
(3)某同学设计利用电解法制取漂白液或Fe(OH)2的实验装置如上图2所示。若通过电解饱和食盐水来制漂白液,则b为电源的_____极,该装置中发生的总反应方程式为_____________________
若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用_____________材料作电极。
II.已知一种锌铁电池的反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时,正极反应式为_______________________
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时,正极反应式为_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产生活中有重要作用。
(1)已知:①氢气的燃烧热为285 kJ/mol ②N2(g) + 2O2(g) = 2NO2(g) ΔH=+133 kJ/mol。试写出H2还原NO2生成液态水和另一种无毒物质的热化学方程式_________________。
(2)一氯胺(NH2Cl)的电子式为_______________,一氯胺是重要的水消毒剂,其原因是一氯胺在水中会部分水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为______________。
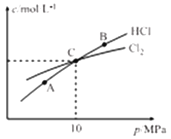
(3)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 20 | 40 | 60 | 80 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应的ΔH______0(填“>”或“<”) ,乙容器中,0~40 min内用Cl2的浓度变化表示的平均反应速率v(Cl2)=_______________________。
②对该反应,下列说法不正确的是________________(填选项字母)。
A.若甲容器内气体密度不变,则表明反应达到平衡状态
B.若乙容器内Cl2和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,分离出少量产物NHCl2,有助于提高Cl2的转化率
③恒温条件下,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示,则A、B、C三点中Cl2转化率最高的是_________(填“A”“B”或“C”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com