
【题目】常温下,溶液M中存在的离子有A2- HA- H+ OH-等,存在的分子有H2O 、H2A 。根据题意回答下列问题:
(1)写出酸H2A的电离方程式:__________________________________________
(2)若溶液M由10mL 2mol.L-1NaHA溶液与10mL 2mol.L-1NaOH溶液混合而得,则溶液M中离子浓度由大到小的顺序为_____________________。已知常温下,Ksp(BaA)=1.8×10-10,向该混合溶液中加入10mL 1mol.L-1BaCl2溶液,混合后溶液中的C(Ba2+)为__________mol.L-1。
(3)若NaHA溶液呈碱性,则溶液M有下列三种情况:①0.01 mol.L-1的H2A溶液;②0.01 mol.L-1的NaHA溶液;③0.02 mol.L-1的HCl溶液与0.04 mol.L-1的NaHA溶液等体积混合而成。则三种情况的溶液中C(H2A)最大的为__________(填序号,下同);pH由大到小的顺序为_______
【答案】![]() 、
、![]()
![]()
![]() ③ ②>③>①
③ ②>③>①
【解析】
(1)存在的分子有H2O、H2A,则H2A为弱酸;
(2)当NaHA与NaOH等物质的量反应后生成Na2A,共0.02mol,由于A2-水解使得溶液显碱性,pH>7,根据溶液呈碱性判断离子浓度;由反应式Ba2++A2-=BaA↓可得:沉淀后A2-过量0.01mol,溶液中c(A2-)=1/3molL-1,根据BaA的Ksp=c(Ba2+)c(A2-)可得c(Ba2+);
(3)①弱酸电离,②中水解生成分子,③中等体积混合后为等量的NaCl、NaHA、H2A,抑制弱酸的电离。
(1)存在的分子有H2O、H2A,则H2A为弱酸,电离方程式为 ![]() 、
、![]() ,故答案为:
,故答案为:![]() 、
、![]() ;
;
(2)当NaHA与NaOH等物质的量反应后生成Na2A,共0.02mol,由于A2-水解使得溶液显碱性,pH>7,可得溶液中离子浓度的大小顺序为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+);由反应式Ba2++A2-=BaA↓可得:沉淀后A2-过量0.01mol,溶液中c(A2-)=1/3molL-1,根据BaA的Ksp=c(Ba2+)c(A2-)可得c(Ba2+)=Ksp/c(A2-)=![]() molL-1,故答案为:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+);
molL-1,故答案为:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+);![]() ;
;
(3)①弱酸电离,②中水解生成分子,③中等体积混合为等量的NaCl、NaHA、H2A,抑制弱酸的电离,则三种情况的溶液中H2A分子浓度最大的为③,最小的为②,②中水解显碱性,①③相比①的酸性强,则pH最小,所以②>③>①,故答案为:③;②>③>①。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】现将0.4 mol A气体和0.2 mol B气体充入10 L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如图:

(1)若t1=10 min,则0至t1时间内C物质的平均反应速率为________;该反应在t1时达到平衡,其化学方程式为____________________________________。
(2)据图中曲线变化情况分析,t1时刻改变的反应条件可能是________。
A.加入了催化剂 B.降低了反应温度
C.向容器中充入了C D.缩小了容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示水解的离子方程式正确的是
A. CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
B. NH4++H2O![]() NH4OH+H+
NH4OH+H+
C. S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D. HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物的性质在人类进步过程中具有极为重要的意义。
(1)肼(N2H4)与N2O4分别是火箭发射中最常用的燃料与氧化剂。已知2N2H4(l)+N2O4(l)===3N2(g)+4H2O(l) ΔH=-1 225 kJ·mol-1。几种化学键的键能数据如下:
化学键 | N—H | N—N | N≡N | O—H |
键能/(kJ·mol-1) | 390 | 190 | 946 | 460 |
则1 mol N2O4(l)完全分解成相应的原子时需要吸收的能量是________。
(2)N2O4与NO2转化的热化学方程式为N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ·mol-1。
2NO2(g) ΔH=+24.4 kJ·mol-1。
①将一定量的N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是________(填字母)。
a.v正(N2O4)=2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
②在一密闭容器中发生该反应,达到平衡后,保持体积不变升高温度,再次达到平衡时,则混合气体的颜色________(填“变深”“变浅”或“不变”),判断理由______________________________________。
③平衡常数K可用反应体系中气体物质平衡分压表示,即K表达式中平衡浓度可用平衡分压代替,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数K的表达式________(用p总、各气体物质的量分数x表示);影响K的因素为________。
(3)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,限着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2/span>)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①该温度下,若向同容积的另一容器中投入N2、H2、NH3,其浓度均为3 mol·L-1,则此时v正________________(填“大于”“小于”或“等于”)。
②由表中的实验数据可得到“c—t”的关系,如图1所示,表示c(N2)—t的曲线是________。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为________。
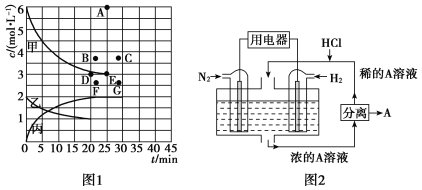
(4)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示。电池正极的电极反应式是____________________,A是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一容积可变的恒压密闭容器里,反应3A(g)![]() B(g)+3C(g) 达到平衡时,A、B和C的物质的量分别为6 mol、2 mol、6 mol。在保持温度和压强不变的情况下,下列说法正确的是
B(g)+3C(g) 达到平衡时,A、B和C的物质的量分别为6 mol、2 mol、6 mol。在保持温度和压强不变的情况下,下列说法正确的是
A.将A、B、C各减少1 mol,C的百分含量减少
B.充入A、B、C各2 mol,平衡将向正反应方向移动
C.充入1mol A,C的体积分数增加
D.充入1 mol氦(He与容器中气体不反应),平衡将向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是
A.氢氧化镁中滴加盐酸:H++OH-=H2O
B.碳酸氢钙溶液中加入氢氧化钠溶液:HCO3-+OH-=CO32-+H2O
C.金属铝溶于氢氧化钠溶液:2Al +2OH-+6H2O=2[Al(OH)4]-+3H2↑
D.用FeCl3溶液腐蚀铜电路板:Fe3++Cu=Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是
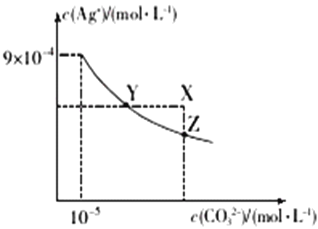
A. Ag2CO3的Ksp为8.1×10-12
B. Ag2CO3(s)+2Cl-(aq)2AgCl(s)+CO32-(aq)的平衡常数K=2.5×108
C. 在Ag2CO3的饱和溶液中加入K2CO3(s)可使c(CO32-)增大(由Y点到Z点)
D. 在0.001molL-1AgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,CO32-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙烧杯中X为阳离子交换膜。请按要求回答相关问题:
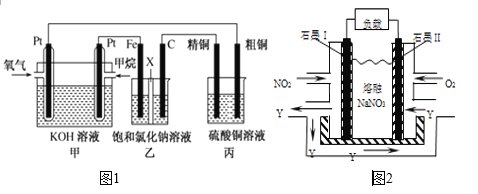
(1)甲烷燃料电池负极电极反应式是___________;正极电极反应式是___________________
(2)石墨(C)为__________极,其电极反应式为____________________________;乙中总反应的离子方程式为__________________________________________________
(3)若在标准状况下,有2.24 L氧气参加反应,则丙装置中阴极析出铜的质量为_________g ;
(4)若将甲装置中的甲烷换成甲醇(CH3OH),KOH溶液换成稀硫酸,则负极电极反应式为___________,消耗等量氧气时,需要甲烷与甲醇的物质的量之比为_________。
(5)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图2,该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于裂解和裂化的叙述不正确的是( )
①裂解与裂化的产物都含有不饱和烃 ②裂解与裂化都是为了得到气态烃 ③裂解与裂化的原料都是石油分馏产品 ④裂解与裂化都是为了得到轻质油
A.①②B.②③C.①③D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com