
����Ŀ����ͼ1��ʾ��ijͬѧ�����һ��ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ�����������ձ���XΪ�����ӽ���Ĥ���밴Ҫ��ش�������⣺
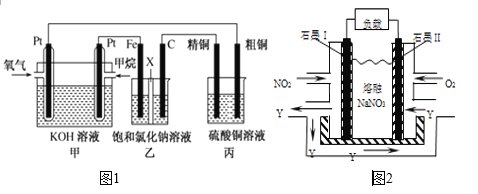
��1������ȼ�ϵ�ظ����缫��Ӧʽ��___________�������缫��Ӧʽ��___________________
��2��ʯī(C)Ϊ__________������缫��ӦʽΪ____________________________�������ܷ�Ӧ�����ӷ���ʽΪ__________________________________________________
��3�����ڱ�״���£���2.24 L�����μӷ�Ӧ�����װ������������ͭ������Ϊ_________g ��
��4��������װ���еļ��黻�ɼ״�(CH3OH),KOH��Һ����ϡ���ᣬ���缫��ӦʽΪ___________�����ĵ�������ʱ����Ҫ������״������ʵ���֮��Ϊ_________��
��5��NO2��O2������NaNO3������ȼ�ϵ�أ���ԭ����ͼ2���õ����ʹ�ù�����ʯīI�缫������������Y����缫��ӦʽΪ________________________________
���𰸡�CH4+10OH--8e����CO32-+7H2OO2+2H2O+4 e����4OH-��2Cl����2e����Cl2����2Cl��+2H2O![]() 2OH-+H2��+Cl2��12.8gCH3OH-6e��+H2O=CO2+6H+3:4NO2+NO3-��2e�� =N2O5
2OH-+H2��+Cl2��12.8gCH3OH-6e��+H2O=CO2+6H+3:4NO2+NO3-��2e�� =N2O5
��������
��1��ȼ�ϵ���У�������Ͷ��ȼ��������Ͷ�ż���ĵ缫�Ǹ�����������ʧ���ӷ���������Ӧ���缫��ӦʽΪ��CH4+10OH--8e����CO32-+7H2O���������������õ��ӵĻ�ԭ��Ӧ���缫��ӦʽΪ��O2+2H2O+4e����4OH-��
�ʴ�Ϊ��CH4+10OH--8e����CO32-+7H2O��O2+2H2O+4e����4OH-��
��2������Ͷ���������ĵ缫��������������װ����ʯī�缫��������������������ʧ���ӷ���������Ӧ���缫��ӦʽΪ��2Cl����2e��=Cl2���������ܷ�Ӧ�����ӷ���ʽΪ2Cl��+2H2O![]() 2OH-+H2��+Cl2����
2OH-+H2��+Cl2����
�ʴ�Ϊ������2Cl����2e��=Cl2����2Cl��+2H2O![]() 2OH-+H2��+Cl2����
2OH-+H2��+Cl2����
��3�����������ת�Ƶ�������ȣ����ڱ�״���£���2.24L�����μӷ�Ӧ����ת�Ƶ��ӵ����ʵ���=![]() ��4=0.4mol����װ��������������ͭ��������ͭ������Ϊxg��
��4=0.4mol����װ��������������ͭ��������ͭ������Ϊxg��
2Cu 2++2e��=Cu
2mol 64g
0.4mol xg
���x=12.8��
�ʴ�Ϊ��12.8��
��4���ڼ״�ȼ�ϵ���У���������ȼ�ϼ״�����ʧ���ӵ�������Ӧ�������Ի����£������缫��ӦʽΪCH3OH-6e��+H2O=CO2+6H+���ɵ缫��Ӧʽ��֪��1mol CH4ת��8mol������1mol CH3OHת��6mol���������ݵ����غ㣬�����ĵ�������ʱ����ת�Ƶ��ӵ����ʵ�����ͬʱ����Ҫ������״������ʵ���֮��Ϊ![]() =3:4��
=3:4��
�ʴ�Ϊ��CH3OH-6e��+H2O=CO2+6H+��3:4��
��5�������ڢ�缫�Ϸ�����ԭ��Ӧ���缫���Ϸ���������Ӧ��NO2���������ɵ�������ֻ����N2O5���缫���ϵĵ缫��ӦʽΪ��NO2+NO3-��2e�� =N2O5��
�ʴ�Ϊ��NO2+NO3-��2e�� =N2O5��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤��ͭ��ϡ���ᷴӦ����NO��ijУѧ��ʵ��С�������һ��ʵ�飬��װ����ͼ��ʾ������װ�ú̶�װ�þ�����ȥ����BΪһ���ý���˿�̶��ĸ���ܣ���װ��״̼��ƹ��壻EΪһ���յ�������ƿ��F�����ڹ��������˫��������
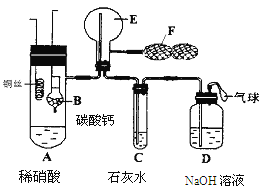
��1�� ʵ��ʱ���Ƚ�Bװ�����ƣ�ʹ̼�����ϡ����Ӵ��������壬��C��������ɫ����ʱ�����̽�Bװ�����ᣬʹ֮��ϡ������롣����ѧ����ƴ˲�������Ŀ��Ϊ ��
��2����A��ͭ˿����ϡ�����У���װ��A���ȣ���װ��A�в�����ɫ���壬�䷴Ӧ�Ļ�ѧ����ʽΪ ��
��3��װ��E�п�ʼʱ����dz����ɫ���壬��F��E�й�������ɹ۲쵽��ƿE��������ɫ����������������ԭ���� ��
��4��һ��ʱ���C�а�ɫ�����ܽ⣬��ԭ����________________________ __��
��5��װ��D��������_________ ___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������,��ҺM�д��ڵ�������A2- HA- H+ OH-��,���ڵķ�����H2O ��H2A ����������ش���������:
��1��д����H2A�ĵ��뷽��ʽ:__________________________________________
��2������ҺM��10mL 2mol.L-1NaHA��Һ��10mL 2mol.L-1NaOH��Һ��϶���,����ҺM������Ũ���ɴ�С��˳��Ϊ_____________________����֪������,Ksp��BaA��=1.8��10-10,��û����Һ�м���10mL 1mol.L-1BaCl2��Һ,��Ϻ���Һ�е�C��Ba2+��Ϊ__________mol.L-1��
��3����NaHA��Һ�ʼ��ԣ�����ҺM�������������:��0.01 mol.L-1��H2A��Һ;��0.01 mol.L-1��NaHA��Һ;��0.02 mol.L-1��HCl��Һ��0.04 mol.L-1��NaHA��Һ�������϶��ɡ��������������Һ��C��H2A������Ϊ__________�������,��ͬ��;pH�ɴ�С��˳��Ϊ_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������з���������ˮ����������к��зḻ�ĵ⡣Ϊ�˴Ӻ�������ȡ�⣬ij�о���ѧϰС����Ʋ�����������ʵ�飺

(1)����ٵ�ʵ�����������________��
(2)�����ձ����������Լ���Ҫ�ļг���������Ʒ����ɲ���ٵ�ʵ����ȱ�ٵIJ���������_________________��������е���ȡ����ѡ��________________
(3)������з�Ӧ�����ӷ���ʽ��______________________________��
(4)�����һ�ּ�ʵ�鷽����������ȡ����ˮ��Һ���Ƿ��е��ʵ⣺_________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������1�������к���9��̼ԭ�ӣ���һ�ȴ���ֻ�����֣��������������ǣ� ��
A.������B.2��6-��������
C.2��2��4��4-�ļ�����D.2��3��4-��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.Ǧ�����ǵ��͵Ŀɳ��͵�أ����������������Ƕ��Բ��ϣ�����ܷ�ӦʽΪ��Pb+PbO2+2 H2SO4![]() 2PbSO4+2H2O���������������:
2PbSO4+2H2O���������������:
��1���ŵ�ʱ�������ĵ缫��Ӧʽ��____________________;���Һ��H2SO4��Ũ�Ƚ���_______������ߡ�С����;�����·ͨ��1 mol����ʱ�������ϸ��������������_________________g��
��2������ȫ�ŵ�ľ�PbO2��Pbʱ����������ͼ1���ӣ����һ��ʱ�������A�缫������__________��B�缫������__________,���ֳ�����ӷ�ʽ�Ƿ���ȷ��_______����ǡ����ߡ���
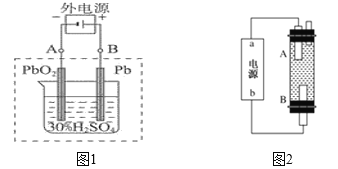
��3��ijͬѧ������õ�ⷨ��ȡƯ��Һ��Fe(OH)2��ʵ��װ������ͼ2��ʾ����ͨ����ⱥ��ʳ��ˮ����Ư��Һ����bΪ��Դ��_____������װ���з������ܷ�Ӧ����ʽΪ_____________________
��������Fe(OH)2��ʹ�����������������Һ������ѡ��_____________�������缫��
II.��֪һ��п����صķ�ӦΪ��3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH���õ�طŵ�ʱ,������ӦʽΪ_______________________
3Zn(OH)2+2Fe(OH)3+4KOH���õ�طŵ�ʱ,������ӦʽΪ_______________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ����
A. ���³�ѹ�£�7.0 g�ɶ�ϩ���ϩ��ɵĻ�������к��е���ԭ����ĿΪNA
B. T ��ʱ��1 L pH=6�Ĵ�ˮ�У���OH-����ĿΪ10-8NA
C. ��1 L���ܱ������г���46 g NO2���壬����������ķ�����ΪNA
D. ��״���£�1 mol Na2O2��22.4 L SO2��Ӧ��ת�Ƶ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣�����Ա������б��Ϊ�١����Ԫ�ػش��������⡣
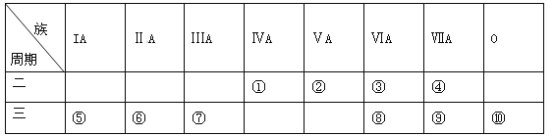
��1���ǽ�������ǿ��Ԫ����______(��Ԫ�ط��ţ���ͬ)���γɻ�������������Ԫ����____________��
��2����������Ԫ�س�����ԭ�Ӱ뾶��С����______(��Ԫ�ط���)����ЩԪ�ص�����������Ӧˮ�����м�����ǿ����__________(�ѧʽ����ͬ)���������Ե���____________��
��3���ݢޢߵ��ʵĻ�����˳��Ϊ______��______��______(��Ԫ�ط���)���жϵ�ʵ��������_______(д��һ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����úת��Ϊˮú������Ҫ��ѧ��ӦΪC(s)��H2O(g)![]() CO(g)��H2(g)��C(s)��CO(g)��H2(g)��ȫȼ�յ��Ȼ�ѧ����ʽΪ��
CO(g)��H2(g)��C(s)��CO(g)��H2(g)��ȫȼ�յ��Ȼ�ѧ����ʽΪ��
C(s)��O2(g)===CO2(g)�� ��H����393.5 kJ��mol��1
2H2(g)��O2(g)===2H2O(g) ��H����484.0 kJ��mol��1
2CO(g)��O2(g)===2CO2(g) ��H����566.0 kJ��mol��1
��1�������������ݣ�д��C(s)��ˮ������Ӧ���Ȼ�ѧ��Ӧ����ʽ��__________________________��
��2���ȽϷ�Ӧ�����ݿ�֪��1 mol CO(g)��1 mol H2(g)��ȫȼ�շų�������֮�ͱ�1 mol C(s)��ȫȼ�շų��������ࡣ��ͬѧ�ݴ���Ϊ��úת��Ϊˮú������ʹúȼ�շų����������������ͬѧ���ݸ�˹������������ѭ��ͼ:
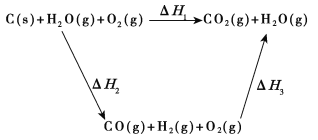
���ݴ���Ϊ��úת��Ϊˮú����ȼ�շų���������úֱ��ȼ�շų����������������ס�����ͬѧ�۵���ȷ����_____(����������������)���жϵ�������_________________________________________��
��3��ˮú������������������ȼ�ϣ�Ҳ����Ҫ���л�����ԭ�ϡ�CO��H2��һ�������¿��Ժϳɣ�
�ټ״����ڼ�ȩ���ۼ��ᡡ�����ᡣ�Է�����CO��H2��1:1������Ȼ�Ϸ�Ӧ���ϳ�����________(�����)����ʱ��������������ɫ��ѧ����Ҫ����ȫ����ԭ���е�ԭ�ӣ�ʵ�����ŷš�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com