
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,7.0 g由丁烯与丙烯组成的混合气体中含有的氢原子数目为NA
B. T ℃时,1 L pH=6的纯水中,含OH-的数目为10-8NA
C. 向1 L的密闭容器中充入46 g NO2气体,容器中气体的分子数为NA
D. 标准状况下,1 mol Na2O2与22.4 L SO2反应,转移电子数为NA
【答案】A
【解析】
A.常温常压下,7.0由丁烯与丙烯组成的混合气体中含有CH2原子团的物质的量为![]() =0.5mol,则含有的氢原子数目为:0.5mol×2×NA=NA,故A正确;B、pH=6的纯水中c(H+)=10-6mol/L,而纯水显中性,故纯水中c(OH-)=10-6mol/L,则氢氧根的物质的量n=cV=10-6mol/L×1L=10-6mol,个数为10-6NA,故B错误;C.NO2中存在平衡:2NO2N2O4,导致分子个数减小,则容器中气体分子个数小于NA个,故C错误;D. 标准状况下,22.4 L SO2为1mol,1mol Na2O2与1molSO2反应生成1mol硫酸钠,转移了2mol电子,转移的电子数为2NA,故D错误;故选A。
=0.5mol,则含有的氢原子数目为:0.5mol×2×NA=NA,故A正确;B、pH=6的纯水中c(H+)=10-6mol/L,而纯水显中性,故纯水中c(OH-)=10-6mol/L,则氢氧根的物质的量n=cV=10-6mol/L×1L=10-6mol,个数为10-6NA,故B错误;C.NO2中存在平衡:2NO2N2O4,导致分子个数减小,则容器中气体分子个数小于NA个,故C错误;D. 标准状况下,22.4 L SO2为1mol,1mol Na2O2与1molSO2反应生成1mol硫酸钠,转移了2mol电子,转移的电子数为2NA,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】下列表示水解的离子方程式正确的是
A. CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
B. NH4++H2O![]() NH4OH+H+
NH4OH+H+
C. S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D. HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是
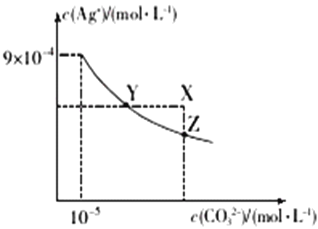
A. Ag2CO3的Ksp为8.1×10-12
B. Ag2CO3(s)+2Cl-(aq)2AgCl(s)+CO32-(aq)的平衡常数K=2.5×108
C. 在Ag2CO3的饱和溶液中加入K2CO3(s)可使c(CO32-)增大(由Y点到Z点)
D. 在0.001molL-1AgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,CO32-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙烧杯中X为阳离子交换膜。请按要求回答相关问题:
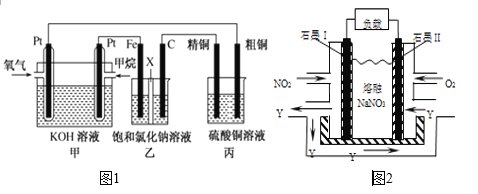
(1)甲烷燃料电池负极电极反应式是___________;正极电极反应式是___________________
(2)石墨(C)为__________极,其电极反应式为____________________________;乙中总反应的离子方程式为__________________________________________________
(3)若在标准状况下,有2.24 L氧气参加反应,则丙装置中阴极析出铜的质量为_________g ;
(4)若将甲装置中的甲烷换成甲醇(CH3OH),KOH溶液换成稀硫酸,则负极电极反应式为___________,消耗等量氧气时,需要甲烷与甲醇的物质的量之比为_________。
(5)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图2,该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(s)+2B(g)![]() C(g)+D(g)已达到平衡状态( )
C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度 ③ B的物质的量浓度 ④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧C、D的分子数之比为1∶1
A. ②③④⑤ B. ①③⑤⑦ C. ②③⑤⑦ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于裂解和裂化的叙述不正确的是( )
①裂解与裂化的产物都含有不饱和烃 ②裂解与裂化都是为了得到气态烃 ③裂解与裂化的原料都是石油分馏产品 ④裂解与裂化都是为了得到轻质油
A.①②B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com