
【题目】现将0.4 mol A气体和0.2 mol B气体充入10 L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如图:

(1)若t1=10 min,则0至t1时间内C物质的平均反应速率为________;该反应在t1时达到平衡,其化学方程式为____________________________________。
(2)据图中曲线变化情况分析,t1时刻改变的反应条件可能是________。
A.加入了催化剂 B.降低了反应温度
C.向容器中充入了C D.缩小了容器体积
【答案】0.001 mol/(L·min)3A(g)+B(g) ![]() 2C(g)AD
2C(g)AD
【解析】
(1)根据v=c/t计算反应速率,根据反应中各物质的变化的物质的量之比等于计量数之比,可写出化学方程式;
(2)根据影响化学反应速率和化学平衡的条件可作判断。
(1)若t1=10 min,则0至t1时间内C物质的平均反应速率为0.1/(10×10)= 0.001 mol/(L·min);根据图可以知道,A、B的物质的量在减小,为反应物,C的物质的量增加,为生成物,且有n(A)=0.40-0.10=0.30mol,n(B)=0.20-0.10=0.10mol;n(C)=0.20-0=0.20mol;再根据反应中各物质的变化的物质的量之比等于计量数之比,该化学方程式为:3A(g)+B(g) ![]() 2C(g) ;综上所述,本题答案是:0.001 mol/(L·min) ,3A(g)+B(g)
2C(g) ;综上所述,本题答案是:0.001 mol/(L·min) ,3A(g)+B(g) ![]() 2C(g)。
2C(g)。
(2) 根据图像,t1时刻不一定是平衡状态,t1-t2不一定是平衡移动,但速率加快;加入了催化剂,加快反应速率,故A正确;降低了反应温度,反应速率减慢,故B错误;向容器中充入了C,C的物质的量应该突变,而图像中C的物质的量是渐变,故C错误;缩小了容器体积,加快反应速率,故D正确;因此,本题正确答案是:AD。


科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
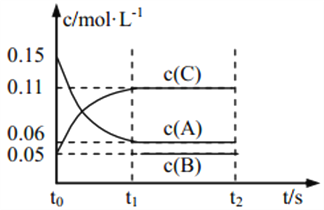
A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X和W同主族且W的单质是重要的半导体材料,Y原子的最外层电子数是其内层电子数的3倍,Z2+与Y2-核外电子排布相同。下列说法正确的是
A. X的氢化物中仅含有极性键
B. X与Y形成的三原子分子的电子式是![]()
C. 原子半径Z>Y,离子半径Z2+< Y2-
D. X、Y的非金属性强弱可用其氧化物的水化物的酸性强弱来推断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素及其化合物性质的比较正确的是( )
A.原子半径:F<O<AlB.稳定性:H2O<PH3<NH3
C.酸性:H2CO3<H2SO4<H3PO4D.碱性:LiOH<NaOH<Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:单质A为目前人类使用最广泛的金属,氧化物B为具有磁性的黑色晶体,根据下列转化关系填空。

(1)试判断:A的化学式为_____________,B的名称为_______________。
(2)实验室检验C溶液中的阳离子时,可加入氢氧化钠溶液,若先产生___________色沉淀,该沉淀在空气中迅速变为灰绿色,最终变为_________色,则含该离子。
(3)实验室检验D溶液中的阳离子时,通常可滴加_________,若溶液变为_______色,则含该离子。
(4)若E是一种黄绿色气体单质,该气体是________________,在C→D过程中,此气体做_________剂。
(5)写出固体B与过量盐酸反应的离子方程式__________________________。
(6)写出D + A→C的离子方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种粒子。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是

A. 反应后溶液的酸性明显增强
B. 消耗1 mol还原剂,转移6 mol电子
C. 该反应的还原剂是Cl-
D. 氧化剂与还原剂的物质的量之比为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件一定能使反应速率加快的是( )
①增加反应物的物质的量;②升高温度;③缩小反应容器的体积;④加入 MnO2
A.全部B.①②④C.②D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明铜与稀硝酸反应产生NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
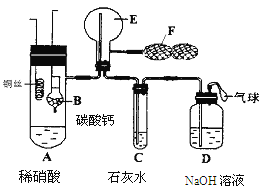
(1) 实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为 。
(3)装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是 。
(4)一段时间后,C中白色沉淀溶解,其原因是________________________ __。
(5)装置D的作用是_________ ___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,溶液M中存在的离子有A2- HA- H+ OH-等,存在的分子有H2O 、H2A 。根据题意回答下列问题:
(1)写出酸H2A的电离方程式:__________________________________________
(2)若溶液M由10mL 2mol.L-1NaHA溶液与10mL 2mol.L-1NaOH溶液混合而得,则溶液M中离子浓度由大到小的顺序为_____________________。已知常温下,Ksp(BaA)=1.8×10-10,向该混合溶液中加入10mL 1mol.L-1BaCl2溶液,混合后溶液中的C(Ba2+)为__________mol.L-1。
(3)若NaHA溶液呈碱性,则溶液M有下列三种情况:①0.01 mol.L-1的H2A溶液;②0.01 mol.L-1的NaHA溶液;③0.02 mol.L-1的HCl溶液与0.04 mol.L-1的NaHA溶液等体积混合而成。则三种情况的溶液中C(H2A)最大的为__________(填序号,下同);pH由大到小的顺序为_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com