
【题目】下列条件一定能使反应速率加快的是( )
①增加反应物的物质的量;②升高温度;③缩小反应容器的体积;④加入 MnO2
A.全部B.①②④C.②D.②③
科目:高中化学 来源: 题型:
【题目】化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )
选项 | 化学反应 | 测量依据(单位时间内) |
A | 2NO2 | 颜色深浅 |
B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
C | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛矿工业中的硫酸酸性废水富含Ti、Fe等元素,其综合利用如下:
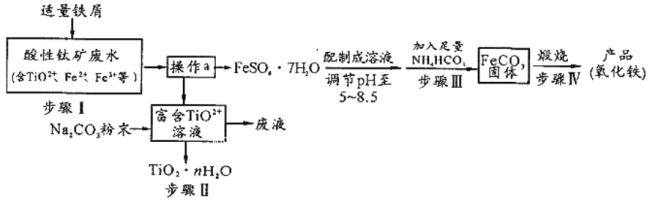
已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)TiO2+钛的化合价为________________________。
(2)步骤Ⅰ中检验钛矿废水中加入铁屑是否足量的试剂是________________________。
(3)操作a是蒸发浓缩、冷却结晶、______________________________________________。
(4)步骤Ⅲ中发生反应的化学方程式为________________________;反应温度一般需控制在35℃以下,其目的是____________________________________。
(5)已知Ksp=[Fe(OH)2] = 8×10-16。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5, c(Fe2+) = 1×10-6mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是_________________。
(6)向“富含TiO2+溶液”中加入Na2CO3粉末易得到固体TiO2 nH2O。请结合原理和化学用语解释其原因_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将0.4 mol A气体和0.2 mol B气体充入10 L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如图:

(1)若t1=10 min,则0至t1时间内C物质的平均反应速率为________;该反应在t1时达到平衡,其化学方程式为____________________________________。
(2)据图中曲线变化情况分析,t1时刻改变的反应条件可能是________。
A.加入了催化剂 B.降低了反应温度
C.向容器中充入了C D.缩小了容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验原理:电极(______、______)、________、________、稀硫酸、耳机(或者电流计)。(请在空格中填写所缺的实验用品)
(3)实验装置(如图)。
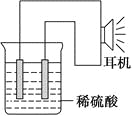
(4)原电池设计及注意的问题:
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓……”的声音。其原因是:在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的________极,电极反应是_____________________________,发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是

A. OE段的平均反应速率最快
B. EF段,用盐酸表示该反应的平均反应速率为0.4 mol/(L·min)
C. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
D. F点收集到的CO2的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为___________________。
(2)由AW两种元素组成的18电子微粒的电子式为______________。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱。常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式_____________________________。
(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式____________________。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为_____________________________。
(6)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,DA能与水反应放出氢气,若将1molDA和0.5molE单质混合加入足量的水,充分反应后生成气体的体积是___________(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示水解的离子方程式正确的是
A. CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
B. NH4++H2O![]() NH4OH+H+
NH4OH+H+
C. S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D. HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是
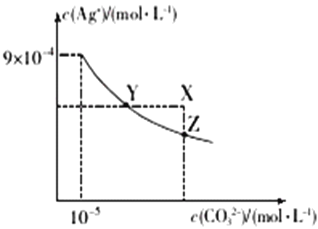
A. Ag2CO3的Ksp为8.1×10-12
B. Ag2CO3(s)+2Cl-(aq)2AgCl(s)+CO32-(aq)的平衡常数K=2.5×108
C. 在Ag2CO3的饱和溶液中加入K2CO3(s)可使c(CO32-)增大(由Y点到Z点)
D. 在0.001molL-1AgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,CO32-先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com