
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为___________________。
(2)由AW两种元素组成的18电子微粒的电子式为______________。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱。常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式_____________________________。
(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式____________________。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为_____________________________。
(6)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,DA能与水反应放出氢气,若将1molDA和0.5molE单质混合加入足量的水,充分反应后生成气体的体积是___________(标准状况下)。
【答案】第三周期,IIIA族![]() BaO2+H2SO4=BaSO4↓+H2O2Cu+2H++H2O2=Cu2++2H2O3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+39.2L
BaO2+H2SO4=BaSO4↓+H2O2Cu+2H++H2O2=Cu2++2H2O3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+39.2L
【解析】
A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素,据此解答。
根据上述分析,A为H元素,B为C元素W为O元素;D为Na元素;E为Al元素。
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(2)由AW两种元素组成的18电子微粒为过氧化氢,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)A2W2为H2O2,是二元弱酸,用硫酸处理BaO2来制备H2O2,则还有BaSO4生成,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2,故答案为:BaO2+H2SO4=BaSO4↓+H2O2;
(4)Cu和稀硫酸不反应,加入具有氧化性的H2O2,可生成硫酸铜和水,反应的离子方程式为Cu+2H++H2O2=Cu2++2H2O,故答案为:Cu+2H++H2O2=Cu2++2H2O;
(5)D的某化合物呈淡黄色,为Na2O2,与氯化亚铁反应的物质的量之比为1:2,且无气体生成,过氧化钠全部为氧化剂,恰好将亚铁离子氧化为铁离子,生成物为Fe(OH)3、NaCl和FeCl3,反应的离子方程式为3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+,故答案为:3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+;
(6)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,为NaH,NaH与水反应放出氢气,反应的方程式为NaH+H2O=NaOH+H2↑,1molNaH放出1mol氢气,同时生成1mol氢氧化钠,氢氧化钠与铝反应也能够放出氢气,2NaOH+2Al+2H2O=2NaAlO2+3H2↑,则0.5mol铝放出0.75mol氢气,因此n(H2)=1mol+0.75mol=1.75mol,V(H2)=1.75mol×22.4L/mol=39.2L,故答案为:39.2L。


科目:高中化学 来源: 题型:
【题目】向黄色的FeCl3溶液加入无色的KSCN溶液,溶液变成血红色,向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,发生该现象的可能原因是__________________________________________________.当其他条件一定时:
(1)向溶液中加入少量的KCl固体,溶液的颜色_______
(2)向溶液中加入少量KSCN固体,溶液的颜色_______
(3)加AgNO3溶液时,化学平衡向_______移动
(4)加入铜粉,溶液的颜色______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:单质A为目前人类使用最广泛的金属,氧化物B为具有磁性的黑色晶体,根据下列转化关系填空。

(1)试判断:A的化学式为_____________,B的名称为_______________。
(2)实验室检验C溶液中的阳离子时,可加入氢氧化钠溶液,若先产生___________色沉淀,该沉淀在空气中迅速变为灰绿色,最终变为_________色,则含该离子。
(3)实验室检验D溶液中的阳离子时,通常可滴加_________,若溶液变为_______色,则含该离子。
(4)若E是一种黄绿色气体单质,该气体是________________,在C→D过程中,此气体做_________剂。
(5)写出固体B与过量盐酸反应的离子方程式__________________________。
(6)写出D + A→C的离子方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件一定能使反应速率加快的是( )
①增加反应物的物质的量;②升高温度;③缩小反应容器的体积;④加入 MnO2
A.全部B.①②④C.②D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明铜与稀硝酸反应产生NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
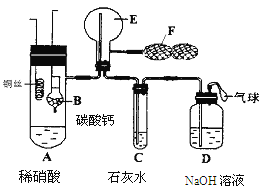
(1) 实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为 。
(3)装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是 。
(4)一段时间后,C中白色沉淀溶解,其原因是________________________ __。
(5)装置D的作用是_________ ___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验:
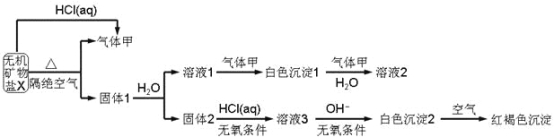
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1.请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,写出气体甲的电子式_______。
(2)X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为_______。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲鱼固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_______,并设计实验方案验证该反应的产物_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置,其中按要求设计正确的是
A. 电解饱和食盐水并验证产物 | B. 铜锌原电池电流方向如图所示 |
C. 在钥匙上电镀银 | D. 电解精炼铜 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃的1个分子中含有9个碳原子,其一氯代物只有两种,该烷烃的名称是( )
A.正壬烷B.2,6-二甲基庚烷
C.2,2,4,4-四甲基戊烷D.2,3,4-三甲基己烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com