
【题目】向黄色的FeCl3溶液加入无色的KSCN溶液,溶液变成血红色,向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,发生该现象的可能原因是__________________________________________________.当其他条件一定时:
(1)向溶液中加入少量的KCl固体,溶液的颜色_______
(2)向溶液中加入少量KSCN固体,溶液的颜色_______
(3)加AgNO3溶液时,化学平衡向_______移动
(4)加入铜粉,溶液的颜色______________
【答案】FeF3比Fe(SCN)2+更难电离(或Fe3+结合F-的能力大于结合SCN-的能力)不变变深逆反应变浅
【解析】
向黄色的FeCl3溶液加入无色的KSCN溶液,溶液变成血红色,发生可逆反应为Fe3++3SCN-![]() Fe(SCN)3;向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,说明Fe3+结合F-的能力大于结合SCN-的能力;综上所述,本题答案是:FeF3比Fe(SCN)2+更难电离(或Fe3+结合F-的能力大于结合SCN-的能力)。
Fe(SCN)3;向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,说明Fe3+结合F-的能力大于结合SCN-的能力;综上所述,本题答案是:FeF3比Fe(SCN)2+更难电离(或Fe3+结合F-的能力大于结合SCN-的能力)。
(1)根据可逆反应:Fe3++3SCN-![]() Fe(SCN)3,向溶液中加入少量的KCl固体,对平衡无影响,溶液的颜色不变;因此本题答案是:不变。
Fe(SCN)3,向溶液中加入少量的KCl固体,对平衡无影响,溶液的颜色不变;因此本题答案是:不变。
(2)根据可逆反应:Fe3++3SCN-![]() Fe(SCN)3,向溶液中加入少量KSCN固体,增加了SCN-离子浓度,平衡右移,溶液的颜色变深;因此本题答案是:变深。
Fe(SCN)3,向溶液中加入少量KSCN固体,增加了SCN-离子浓度,平衡右移,溶液的颜色变深;因此本题答案是:变深。
(3)加AgNO3溶液时,相当于加水稀释,溶液中离子浓度减小,溶液颜色变浅,化学平衡向逆反应移动;因此本题答案是:逆反应。
(4)根据可逆反应:Fe3++3SCN-![]() Fe(SCN)3,加入铜粉,铁离子和铜发生反应,减小了铁离子浓度,平衡左移,溶液的颜色变浅;因此本题答案是:变浅。
Fe(SCN)3,加入铜粉,铁离子和铜发生反应,减小了铁离子浓度,平衡左移,溶液的颜色变浅;因此本题答案是:变浅。


科目:高中化学 来源: 题型:
【题目】已知25℃、101 kPa下,如下图所示,石墨的燃烧热为一393.51 kJ·mol-1,金刚石的燃烧热为一395.4kJ·mol-1。下列表达正确的是

A. 金刚石比石墨稳定
B. C(s、石墨)=C(s、金刚石) △H=+1.9 kJ/mol
C. △H1<△H2
D. 如果使用催化剂,△H1和△H2都变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢分解制取氢气和硫磺的原理为2H2S(g)![]() S2(g)+ 2H2(g),在2.0L恒容密闭容器中充入0.1mol H2S,不同温度下测得H2S的转化率与时间的关系如图所示。下列说法正确的是
S2(g)+ 2H2(g),在2.0L恒容密闭容器中充入0.1mol H2S,不同温度下测得H2S的转化率与时间的关系如图所示。下列说法正确的是

A. 正反应是放热反应
B. 图中P点:v(正)> v(逆)
C. 950℃时,0~1.25s内,生成H2 的 平均反应速率为0.016 mol·l-1 ·s-1
D. 950℃时,该反应的平衡常数的值小于3.125×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )
选项 | 化学反应 | 测量依据(单位时间内) |
A | 2NO2 | 颜色深浅 |
B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
C | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于二氧化氮的下列说法中不正确的是( )
A.二氧化氮是一种红棕色气体
B.二氧化氮是造成酸雨的气体之一
C.二氧化氮易溶于水,不能用排水法收集
D.氮气与氧气反应可直接生成二氧化氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,请用化学用语填空回答以下问题:
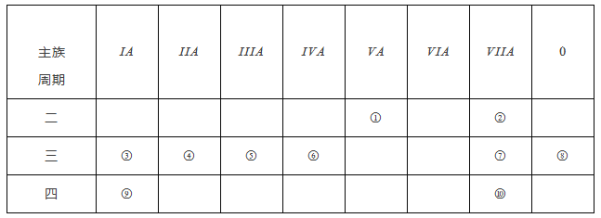
(1)化学性质最不活泼的元素原子的原子结构示意图为________。
(2)元素①、②的简单氢化物的稳定性更强的是______________(用化学式表示,下同)。
(3)元素的最高价氧化物对应的水化物中酸性最强的是______,碱性最强的是____,呈两性的氢氧化物是_________,元素③的最高价氧化物对应水化物中含有的化学键类型为________。
(4)在③~⑦元素中,简单离子半径最小的是_________。
(5)元素③的过氧化物的电子式为_________。
(6)在⑦与⑩的单质中,氧化性较强的是_____,用化学反应方程式证明:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )

A. 500 mL 2.0 mol·L-1HCl溶液和500 mL 2.0 mol·L-1NaOH溶液的反应符合图(a),且放出热量为ΔE1
B. 500 mL 2.0 mol·L-1H2SO4溶液和500 mL 2.0 mol·L-1Ba(OH)2溶液的反应符合图(b),且吸收热量为ΔE2
C. 发生图(a)能量变化的任何反应,一定不需要加热即可发生
D. CaO、浓硫酸分别溶于水时的能量变化均符合图(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛矿工业中的硫酸酸性废水富含Ti、Fe等元素,其综合利用如下:
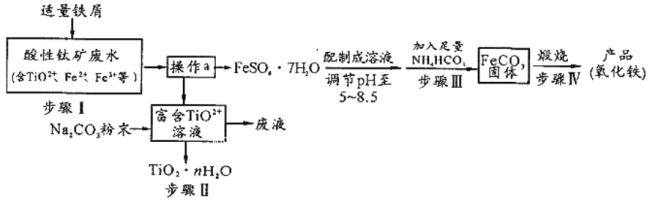
已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)TiO2+钛的化合价为________________________。
(2)步骤Ⅰ中检验钛矿废水中加入铁屑是否足量的试剂是________________________。
(3)操作a是蒸发浓缩、冷却结晶、______________________________________________。
(4)步骤Ⅲ中发生反应的化学方程式为________________________;反应温度一般需控制在35℃以下,其目的是____________________________________。
(5)已知Ksp=[Fe(OH)2] = 8×10-16。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5, c(Fe2+) = 1×10-6mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是_________________。
(6)向“富含TiO2+溶液”中加入Na2CO3粉末易得到固体TiO2 nH2O。请结合原理和化学用语解释其原因_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为___________________。
(2)由AW两种元素组成的18电子微粒的电子式为______________。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱。常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式_____________________________。
(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式____________________。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为_____________________________。
(6)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,DA能与水反应放出氢气,若将1molDA和0.5molE单质混合加入足量的水,充分反应后生成气体的体积是___________(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com