
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,请用化学用语填空回答以下问题:
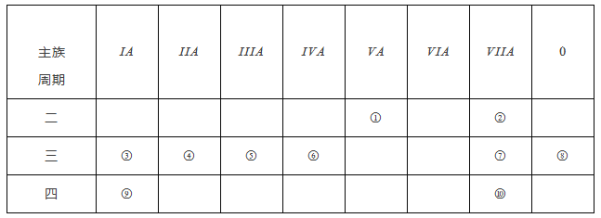
(1)化学性质最不活泼的元素原子的原子结构示意图为________。
(2)元素①、②的简单氢化物的稳定性更强的是______________(用化学式表示,下同)。
(3)元素的最高价氧化物对应的水化物中酸性最强的是______,碱性最强的是____,呈两性的氢氧化物是_________,元素③的最高价氧化物对应水化物中含有的化学键类型为________。
(4)在③~⑦元素中,简单离子半径最小的是_________。
(5)元素③的过氧化物的电子式为_________。
(6)在⑦与⑩的单质中,氧化性较强的是_____,用化学反应方程式证明:______。
【答案】![]() HF HClO4 KOH Al(OH)3 离子键和共价键 Al3+
HF HClO4 KOH Al(OH)3 离子键和共价键 Al3+ ![]() Cl2 Cl2+2KBr=2KCl+Br2
Cl2 Cl2+2KBr=2KCl+Br2
【解析】
由元素在周期表中位置可知,①为N元素、②为F元素、③为Na元素、④为Mg元素、⑤为Al元素、⑥为Si元素、⑦为Cl元素、⑧为Ar元素、⑨为K元素、⑩为Br元素。
(1)化学性质最不活泼的元素为0族元素Ar元素,Ar原子的原子结构示意图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)同周期元素元素,从左到右非金属性依次增强,氢化物的稳定性依次增强,①为N元素、②为F元素,氟化氢的稳定性强于氨气,故答案为:HF;
(3)同周期元素元素,从左到右非金属性依次增强,碱性依次减弱,最高价氧化物对应水化物的酸性依次增强,碱性依次减弱,同主族元素元素,从下到上非金属性依次减弱,金属性依次增强,最高价氧化物对应水化物的酸性依次减弱,碱性依次增强,则酸性最强的是高氯酸,碱性最强的是氢氧化钾;两性的氢氧化物是氢氧化铝,氢氧化钠为离子化合物,含有离子键和共价键,故答案为:HClO4;KOH;Al(OH)3;离子键和共价键;
(4)同主族元素从上到下,离子半径依次增大,电子层结构相同的离子,随核电荷数增大,离子半径依次减小,则③~⑦元素中,简单离子半径最小的是Al3+,故答案为:Al3+;
(5)过氧化钠为离子化合物,是由钠离子和过氧根离子形成,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(6)氯气的氧化性强于溴,氯气能与溴化钾发生置换反应生成单质溴和氯化钠,反应的化学方程式为Cl2+2KBr=2KCl+Br2,故答案为:Cl2;Cl2+2KBr=2KCl+Br2。


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】用石墨作电极电解1 mol/L CuSO4溶液,当c(Cu2+)为0.5 mol/L时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状态( )
A.CuSO4B.CuOC.Cu(OH)2D.CuSO4·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
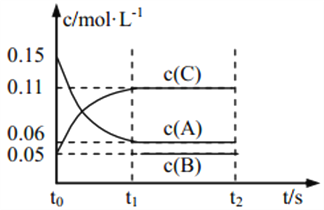
A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)以 Fe 和 Cu 为电极,稀 H2SO4 为电解质溶液形成的原电池中:
①H+向______极移动(填“正”或“负”)。
②电子流动方向由_____极流向______极(填:“正”、“负”)。
③若有 1mol e- 流过导线,则理论上负极质量减少______g。
④若将稀硫酸换成浓硝酸,负极电极方程式为:___________。
(2)甲烷燃料电池是一种高效无污染的清洁电池,它用 KOH 做电解质。则负极反应方程式是________。
(3)一定温度下,在容积为 2L 的密闭容器中进行反应:aN(g)![]() bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:

①反应化学方程式中各物质的系数比为 a∶b∶c=____。
②1 min 到 3 min 这段时刻,以 M 的浓度变化表示的平均反应速率为:______。
③下列叙述中能说明上述反应达到平衡状态的是_____。
A 反应中当 M 与 N 的物质的量相等时
B P 的质量不随时间变化而变化
C 混合气体的总物质的量不随时间变化而变化
D 单位时间内每消耗 a mol N,同时消耗 b mol M
E 混合气体的压强不随时间的变化而变化F.M 的物质的量浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向黄色的FeCl3溶液加入无色的KSCN溶液,溶液变成血红色,向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,发生该现象的可能原因是__________________________________________________.当其他条件一定时:
(1)向溶液中加入少量的KCl固体,溶液的颜色_______
(2)向溶液中加入少量KSCN固体,溶液的颜色_______
(3)加AgNO3溶液时,化学平衡向_______移动
(4)加入铜粉,溶液的颜色______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将1mol的CO和1mol水蒸气通入容器中发生下述反应:
CO+H2O![]() CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
A. 等于0.6mol B. 等于1mol
C. 大于0.6mol且小于1mol D. 大于1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X和W同主族且W的单质是重要的半导体材料,Y原子的最外层电子数是其内层电子数的3倍,Z2+与Y2-核外电子排布相同。下列说法正确的是
A. X的氢化物中仅含有极性键
B. X与Y形成的三原子分子的电子式是![]()
C. 原子半径Z>Y,离子半径Z2+< Y2-
D. X、Y的非金属性强弱可用其氧化物的水化物的酸性强弱来推断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素及其化合物性质的比较正确的是( )
A.原子半径:F<O<AlB.稳定性:H2O<PH3<NH3
C.酸性:H2CO3<H2SO4<H3PO4D.碱性:LiOH<NaOH<Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明铜与稀硝酸反应产生NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
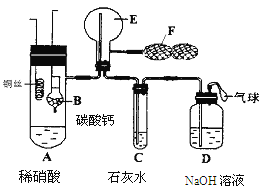
(1) 实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为 。
(3)装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是 。
(4)一段时间后,C中白色沉淀溶解,其原因是________________________ __。
(5)装置D的作用是_________ ___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com