
【题目】按要求回答问题:
(1)以 Fe 和 Cu 为电极,稀 H2SO4 为电解质溶液形成的原电池中:
①H+向______极移动(填“正”或“负”)。
②电子流动方向由_____极流向______极(填:“正”、“负”)。
③若有 1mol e- 流过导线,则理论上负极质量减少______g。
④若将稀硫酸换成浓硝酸,负极电极方程式为:___________。
(2)甲烷燃料电池是一种高效无污染的清洁电池,它用 KOH 做电解质。则负极反应方程式是________。
(3)一定温度下,在容积为 2L 的密闭容器中进行反应:aN(g)![]() bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:

①反应化学方程式中各物质的系数比为 a∶b∶c=____。
②1 min 到 3 min 这段时刻,以 M 的浓度变化表示的平均反应速率为:______。
③下列叙述中能说明上述反应达到平衡状态的是_____。
A 反应中当 M 与 N 的物质的量相等时
B P 的质量不随时间变化而变化
C 混合气体的总物质的量不随时间变化而变化
D 单位时间内每消耗 a mol N,同时消耗 b mol M
E 混合气体的压强不随时间的变化而变化F.M 的物质的量浓度保持不变
【答案】正 负 正 28 Cu—2e―=Cu2+ CH4-8e-+10 OH-=CO32-+7H2O 2:1:1 0.25mol/(L·min) BDF
【解析】
(1)由于金属活动性Fe强于Cu,所以Fe做负极,Fe失电子发生氧化反应生成Fe2+,电极反应式为Fe—2e―=Fe2+,Cu做正极,氢离子在正极上得电子发生还原反应生成氢气,电极反应式为2H++2e―=H2↑,电子由负极Fe经导线流向正极Cu,H+向负电荷较多的正极移动;
(2)燃料电池工作时,负极为甲烷,碱性条件下,甲烷在负极失电子发生氧化反应,电极反应式为CH4-8e-+10OH-=CO32-+7H2O,正极是氧气,氧气在正极得电子发生还原反应,电极反应式为O2+4e-+2H2O=4OH-。
(3) 由图像可知,达到平衡时N的物质的量减少了(8—2)mol=6 mol,M增加了(5—2)mol=3mol,P增加了(4—1)mol=3mol,由化学计量数之比等于变化量之比可得a:b∶c=6:3:3=2:1:1,则反应的化学方程式为2N(g)![]() M(g)+P(g)。
M(g)+P(g)。
(1)①H+向负电荷较多的正极移动,故答案为:正;
②电子由负极Fe经导线流向正极Cu,故答案为:负;正;
③Fe做负极,Fe失电子发生氧化反应生成Fe2+,电极反应式为Fe—2e―=Fe2+,若有 1mol e- 流过导线,由电极反应式可知负极消耗Fe的质量为0.5mol×56g/mol=28g,故答案为:28;
④若将稀硫酸换成浓硝酸,Fe在浓硝酸中钝化,铜与浓硝酸反应生成硝酸铜、二氧化氮和水,则Fe做正极,Cu做负极,Cu失电子发生氧化反应生成Cu2+电极反应式为Cu—2e―=Cu2+,故答案为:Cu—2e―=Cu2+;
(2)碱性甲烷燃料电池工作时,具有还原性的甲烷为原电池的负极,甲烷在负极失电子发生氧化反应,电极反应式为CH4-8e-+10OH-=CO32-+7H2O,故答案为:CH4-8e-+10OH-=CO32-+7H2O;
(3)①由图像可知,达到平衡时N的物质的量减少了(8—2)mol=6 mol,M增加了(5—2)mol=3mol,P增加了(4—1)mol=3mol,由化学计量数之比等于变化量之比可得a:b∶c=6:3:3=2:1:1,故答案为:2:1:1;
②1 min 到 3 min 这段时刻,M增加了(4—3)mol=1mol,以 M 的浓度变化表示的平均反应速率为v(M)=![]() =
=![]() =0.25mol/(L·min),故答案为:0.25mol/(L·min);
=0.25mol/(L·min),故答案为:0.25mol/(L·min);
③A、反应中当 M 与 N 的物质的量相等时,该反应不一定达到平衡状态,与反应初始物质的量及转化率有关,故错误;
B、P 的质量不随时间变化而变化,说明正逆反应速率相等,反应达到平衡状态,故正确;
C、该反应是气体体积不变的反应,混合气体的总物质的量始终不变,混合气体的总物质的量不随时间变化而变化,不能说明反应达到平衡状态,故错误;
D、单位时间内每消耗 a mol N,同时消耗 b mol M说明正逆反应速率相等,反应达到平衡状态,故正确;
E、该反应是气体体积不变的反应,混合气体的压强终不变,混合气体的压强不随时间的变化而变化,不能说明反应达到平衡状态,故错误;
F、M 的物质的量浓度保持不变,说明正逆反应速率相等,反应达到平衡状态,故正确;
BDF正确,故答案为:BDF。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是
A. 灼热的炭与CO2反应 B. 氧化铁与铝反应
C. 钠与乙醇反应 D. Ba(OH)2·8H2O与NH4C1反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A元素的一种核素无中子,F元素的最外层电子数是次外层电子数的0.75倍,B元素的的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)A、D、F形成化合物的电子式_____________。
(2)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在2L密闭容器中分别充入1 mol A2C和1 mol BC, —定条件下,2 min达平衡时生成0.4mol A2,则用BC表示的反应速率为________。下列关于该反应的说法中正确的是__________________。
A.增加BC2的浓度始终不能提高正反应速率
B.若混合气体的密度不再发生变化,则反应达到最大限度
C.A2是一种高效优质新能源
D.若生成1 molA2,转移2mol电子
(3)用A元素的单质与C元素的单质及由A、C、D三种元素组成的化合物的溶液构成燃料电池,写出该电池的电极反应式:负极____________,正极_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列说法正确的是
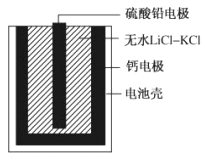
A. 放电过程中,Li+向负极移动
B. 正极反应式:Ca+2Cl-—2e-=CaCl2
C. 每转移0.1mol电子,理论上生成10.35gPb
D. 常温时,在正负极间接上电流表或检流计,指针偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )
选项 | 化学反应 | 测量依据(单位时间内) |
A | 2NO2 | 颜色深浅 |
B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
C | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,请用化学用语填空回答以下问题:
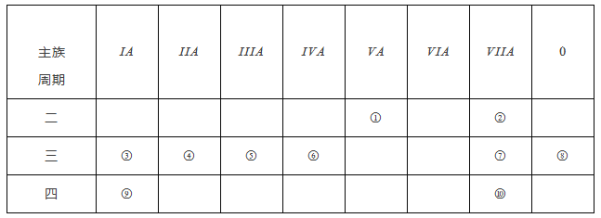
(1)化学性质最不活泼的元素原子的原子结构示意图为________。
(2)元素①、②的简单氢化物的稳定性更强的是______________(用化学式表示,下同)。
(3)元素的最高价氧化物对应的水化物中酸性最强的是______,碱性最强的是____,呈两性的氢氧化物是_________,元素③的最高价氧化物对应水化物中含有的化学键类型为________。
(4)在③~⑦元素中,简单离子半径最小的是_________。
(5)元素③的过氧化物的电子式为_________。
(6)在⑦与⑩的单质中,氧化性较强的是_____,用化学反应方程式证明:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,固定容积的密闭容器中反应:2NO2(g)![]() O2(g)+2NO(g) ΔH>0,达到平衡。当改变其中一个条件X时,Y随X的变化符合图中曲线的是
O2(g)+2NO(g) ΔH>0,达到平衡。当改变其中一个条件X时,Y随X的变化符合图中曲线的是

A. 当X表示温度时,Y表示O2的物质的量
B. 当X表示压强时,Y表示NO2的转化率
C. 当X表示反应时间时,Y表示混合气体的密度
D. 当X表示NO2的物质的量时,Y表示O2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是

A. OE段的平均反应速率最快
B. EF段,用盐酸表示该反应的平均反应速率为0.4 mol/(L·min)
C. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
D. F点收集到的CO2的量最多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com