
【题目】一定温度下,反应C(s)+H2O(g)![]() CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )
CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )
①增加C的物质的量 ②保持体积不变,充入N2使体系压强增大 ③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
A. ①② B. ②③ C. ①④ D. ③④
科目:高中化学 来源: 题型:
【题目】研究氮氧化物的反应机理,对于消除其对环境的污染有重要意义。
(1)升高温度,绝大多数的化学反应速率增大,但是2NO(g)+O2(g) ![]() 2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g)
2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
I.2NO(g) ![]() N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
Ⅱ.N2O2(g)+O2(g) ![]() 2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
请回答下列问题:
①反应2NO(g)+O2(g) ![]() 2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
②决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
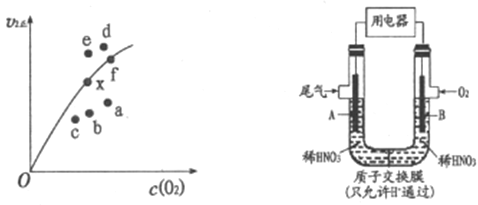
(2)通过图所示装置,可将汽车尾气中的NO、NO2转化为重要的化工原料HNO3,其中A、B为多孔惰性电极。该装置的负极是__________ (填“A”或“B”),B电极的电极反应式为__________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液甲,溶液乙为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c (NO2-)和c(CH3COO-)由大到小的顺序为__________(已知HNO2的电离常数Kα=7.1×10-4mol/L,CH3COOH的电离常数Kα=1.7×10-5mol/L)。可使溶液甲和溶液乙的pH相等的方法是__________。
a.向溶液甲中加适量水 b.向溶液甲中加适量NaOH
c.向溶液乙中加适量水 d.向溶液乙中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氯水能导电,所以氯气是电解质
B.碳酸钙不溶于水,所以它是非电解质
C.固体磷酸是电解质,所以磷酸在熔融状态下和溶于水时都能导电
D.胆矾虽不能导电,但它属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵,析出晶体的化学式为( NH4)2Fe(SO4)2·6H2O。该物质可以溶于水而不溶于乙醇,是一种复盐,在空气中比一般亚铁盐稳定,常被用作氧化还原滴定的基准物。下面是某实验小组制取硫酸亚铁铵的部分装置与实验步骤:
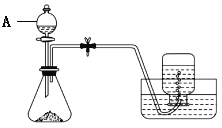
①称取约5 g铁屑放入锥形瓶中,加入15 mL 10% Na2CO3溶液,小火加热10分钟,倒掉剩余的碱液后,用蒸馏水洗净铁屑,干燥。
②称取2.24 g 铁屑放入锥形瓶中,由分液漏斗滴加20 mL 3 mol/L硫酸溶液。
③待反应结束后,由分液漏斗加入适量的(NH4)2SO4溶液,并将上述混合溶液转移至蒸发皿中,缓慢加热,浓缩至表面出现晶膜为止。
④放置冷却,析出晶体,过滤、用无水乙醇洗涤、干燥。
请回答下列问题:
(1)仪器A的名称是___________。
(2)实验开始前,检查反应装置气密性的方法为_______________________________。
(3)步骤①中小火加热的作用是________________________。
(4)步骤②中滴加硫酸溶液时留取少许溶液于分液漏斗中的原因是___________________。
(5)步骤③中理论上需加入2 mol/L (NH4)2SO4溶液______________mL。
(6)无水乙醇洗涤晶体的作用是_______________________________。
(7)取1.00 g高锰酸钾样品,再加入硫酸酸化,并配成250 mL溶液。取出25.00 mL,用浓度为0.1000 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,终点时用去标准液20.00 mL。则滴定时发生反应的离子方程式为_____,该样品中高锰酸钾的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(13分)用辉铜矿(主要成分为 Cu2S,含少量Fe2O3、SiO2,等杂质)制备难溶于水的碱式碳酸铜的流程如下:

(1)下列措施是为了加快浸取速率,其中无法达到目的的是____(填字母)。
A.延长浸取时间 | B.将辉铜矿粉碎 |
C.充分搅拌 | D.适当增加硫酸浓度 |
(2)滤渣I巾的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:_______。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是___________。
(4)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A可以是_______(填化学式);“赶氨”时,最适宜的操作方法是________。
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为_______。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按如图所示转化关系每一步都能一步实现的是
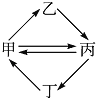
甲 | 乙 | 丙 | 丁 | |
A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
B | Cu | CuO | CuSO4 | CuCl2 |
C | SO2 | H2SO4 | SO3 | H2S |
D | Al(OH)3 | NaAlO2 | Al2O3 | AlCl3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应aA(g)+bB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则
(1)该反应的逆反应是____反应(填“吸热或放热),且a+b___p(填“>”“<”或“=”)。
(2)减压时,A的质量分数______(填“增大”“减小”或“不变”,下同)。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比![]() 将________。
将________。
(5)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色________(填“变浅”“变深”或“不变”,下同),而维持容器内气体的压强不变,充入氖气时,混合物的颜色________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(![]() )抗腐蚀性能好,露置于空气中数年,仍光亮如初.以金红石(主要成分是
)抗腐蚀性能好,露置于空气中数年,仍光亮如初.以金红石(主要成分是![]() )为原料生产金属钦的步骤主要有:①在高温下,向金红石与焦炭的混合物中通入氯气(
)为原料生产金属钦的步骤主要有:①在高温下,向金红石与焦炭的混合物中通入氯气(![]() ),得到
),得到![]() 和一种可燃性气体;②在稀有气体环境和加热条件下,用
和一种可燃性气体;②在稀有气体环境和加热条件下,用![]() 和
和![]() 反应得到
反应得到![]() 和
和![]() ,下列说法不正确的是
,下列说法不正确的是
A. ①中的反应![]()
B. ②中的稀有气体的作用是隔绝空气
C. ②中发生的反应为置换反应
D. 金属钛在常温下不与![]() 反应
反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在酸性溶液中可发生如下反应: R2O72-+ 6Fe2+ + 14H+ =6Fe3+ +2Rn+ +7H2O,则Rn+中R的化合价是
A. +3 B. +4 C. +5 D. +6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com