
【题目】下列说法正确的是( )
A.氯水能导电,所以氯气是电解质
B.碳酸钙不溶于水,所以它是非电解质
C.固体磷酸是电解质,所以磷酸在熔融状态下和溶于水时都能导电
D.胆矾虽不能导电,但它属于电解质
科目:高中化学 来源: 题型:
【题目】一种制备高效漂白剂NaClO2的实验流程如图所示,反应I中发生的反应为3NaClO3+4SO2+3H2O====2ClO2+Na2SO4+3H2SO4+NaCl,下列说法中正确的是

A. 反应Ⅱ中H2O2做还原剂
B. 产品中含有SO42-、Cl-
C. NaClO2的漂白原理与SO2相同
D. 实验室进行结晶操作通常在坩埚中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+2 H2SO4![]() 2PbSO4+2H2O,请完成下列问题:
2PbSO4+2H2O,请完成下列问题:
(1)放电时:正极的电极反应式是____________________;电解液中H2SO4的浓度将变_______(填“大”或者“小”);当外电路通过1 mol电子时,理论上负极板的质量增加_________________g。
(2)在完全放电耗尽PbO2和Pb时,若按如下图1连接,充电一段时间后,则在A电极上生成__________、B电极上生成__________,这种充电连接方式是否正确?_______(填“是”或者“否”)
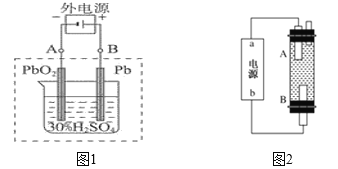
(3)某同学设计利用电解法制取漂白液或Fe(OH)2的实验装置如上图2所示。若通过电解饱和食盐水来制漂白液,则b为电源的_____极,该装置中发生的总反应方程式为_____________________
若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用_____________材料作电极。
II.已知一种锌铁电池的反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时,正极反应式为_______________________
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时,正极反应式为_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3的催化氧化是工业制取硝酸的关键步骤之一,该反应的化学方程式为:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),△H<0。
4NO(g)+6H2O(g),△H<0。
请回答下列问题:
(1)在恒温恒容下判断该反应达到平衡状态的标志是______(填字母)。
a.NH3和NO浓度相等 b.NO百分含量保持不变
c.容器中气体的压强不变 d.NH3的生成速率与NO的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3平衡转化率的是_____________。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.降低温度
(3)将0.050 mol NH3 (g)和0.060 mol O2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(NO)=0.040 mol/L。计算该条件下反应的NH3的转化率。平衡时,NH3的转化率α(NH3 )=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
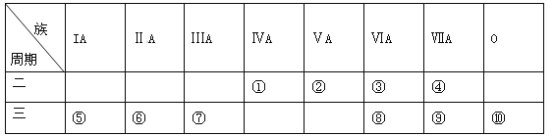
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是____________。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为______>______>______(填元素符号),判断的实验依据是_______(写出一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为五种常见的有机物,它们之间的转化关系如图1所示。其中A是一种可以使溴水及酸性KMnO4溶液褪色的气体,可作为水果的催熟剂。D分子的模型如图2所示。
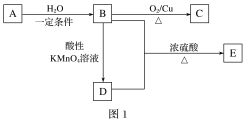

请回答下列问题:
(1)由B生成C的反应类型是________。
(2)A的结构简式为________,D中的官能团为______。
(3)B与D反应生成E的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产生活中有重要作用。
(1)已知:①氢气的燃烧热为285 kJ/mol ②N2(g) + 2O2(g) = 2NO2(g) ΔH=+133 kJ/mol。试写出H2还原NO2生成液态水和另一种无毒物质的热化学方程式_________________。
(2)一氯胺(NH2Cl)的电子式为_______________,一氯胺是重要的水消毒剂,其原因是一氯胺在水中会部分水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为______________。
(3)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 20 | 40 | 60 | 80 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应的ΔH______0(填“>”或“<”) ,乙容器中,0~40 min内用Cl2的浓度变化表示的平均反应速率v(Cl2)=_______________________。
②对该反应,下列说法不正确的是________________(填选项字母)。
A.若甲容器内气体密度不变,则表明反应达到平衡状态
B.若乙容器内Cl2和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,分离出少量产物NHCl2,有助于提高Cl2的转化率
③恒温条件下,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示,则A、B、C三点中Cl2转化率最高的是_________(填“A”“B”或“C”)。
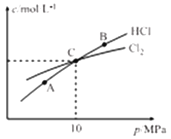
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应C(s)+H2O(g)![]() CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )
CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )
①增加C的物质的量 ②保持体积不变,充入N2使体系压强增大 ③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
A. ①② B. ②③ C. ①④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程的能量变化符合下图所示的是

A. 酸碱中和反应
B. CH4在O2中燃烧
C. NH4Cl晶体与Ba(OH)28H2O晶体混合搅拌
D. CaO溶于水生成Ca(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com