
【题目】已知:pOH=-lgc(OH-)。室温下,将稀盐酸滴加到某一元碱(BOH)溶液中,测得混合溶液的pOH与离子浓度的变化关系如图所示。下列叙述错误的是

A. BOH属于弱碱
B. BOH的电离常数K=1×10-4.8
C. P点所示的溶液中:c(Cl-)>c(B+)
D. N点所示的溶液中:c(H+)=c(Cl-)+c(OH-)-c(BOH)
【答案】C
【解析】
A. 若BOH为强碱,其完全电离,那么c(BOH)为0,那么![]() 这样的式子必然不合理。由图中N点的数据可以计算出BOH的电离常数,可以判断BOH为弱碱,A项正确;
这样的式子必然不合理。由图中N点的数据可以计算出BOH的电离常数,可以判断BOH为弱碱,A项正确;
B.BOH B+ + OH-,所以Kb=![]() ,可得
,可得![]() =-lgKb+lgc(OH-)=-lgKb-pOH,带入N点数据,可得0=-lgKb-4.8,Kb=10-4.8,B项正确;
=-lgKb+lgc(OH-)=-lgKb-pOH,带入N点数据,可得0=-lgKb-4.8,Kb=10-4.8,B项正确;
C.根据电荷守恒得c(Cl-)+ c(OH-)=c(B+)+ c(H+),在P点,pOH<7,说明溶液显碱性,c(OH-)> c(H+),因而c(Cl-)<c(B+),C项错误;
D.N点![]() =0,因而c(B+)= c(BOH),根据电荷守恒,c(Cl-)+ c(OH-)=c(B+)+ c(H+),可变为c(Cl-)+ c(OH-)=c(BOH)+ c(H+),因而c(H+)=c(Cl-)+c(OH-)-c(BOH),D项正确。
=0,因而c(B+)= c(BOH),根据电荷守恒,c(Cl-)+ c(OH-)=c(B+)+ c(H+),可变为c(Cl-)+ c(OH-)=c(BOH)+ c(H+),因而c(H+)=c(Cl-)+c(OH-)-c(BOH),D项正确。
故答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl研细、干燥后,准确称取mgNaCl固体并转移到定容仪器A中。
(2)用滴定管向A仪器中滴加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为Vcm3。
①步骤(1)中A仪器最好用__________(仪器名称)。
②步骤(2)中用酸式滴定管好还是碱式滴定管好,__________,理由是______________。
③能否用胶头滴管代替步骤(2)中的滴定管__________;理由是____________________。
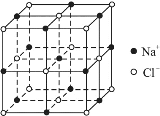
④已知NaCl晶体的结构如上图所示,用X射线测得NaCl晶体中靠得最近的Na+与Cl-间的平均距离为acm,则用上述测定方法测得阿伏加德罗常数NA的表达式为:NA=______mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的工业加工过程中,可利用CO和H2合成甲醇,能量变化如图所示。下列说法正确的是
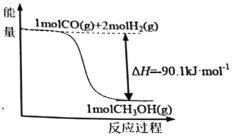
A.该反应是吸热反应
B.1molCH3OH所具有的能量为90.1kJ
C.CO(g)+2H2(g)![]() CH3OH(l) ΔH=-90.1kJ·mol-1
CH3OH(l) ΔH=-90.1kJ·mol-1
D.1molCO和2molH2断键所需能量小于1molCH3OH断键所需能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。

(1) 装置A中发生反应的化学方程式为___________。
(2) 装置D中试管口放置的棉花应浸一种溶液,这种溶液是______,其作用是___________。
(3) 装置B的作用是贮存多余的气体,当D处有明显的现象后,关闭旋塞K,移去酒精灯, 但由于余热的作用,A处仍有气体产生,此时B中现象是____。
Ⅱ.乙酸乙酯广泛用于药物、染料、香料等工业,甲、乙两同学分别设计如下装置来 制备乙酸乙酯,已知:乙酸乙酯的沸点为77.1℃,CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
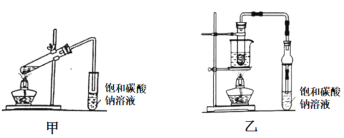
(1)甲装置中右边导管未插入溶液中的目的是 _________。
(2)实验结束后分离出乙酸乙酯的操作是______,必须用到的玻璃仪器有_______(填序号)。
A. 烧杯 B. 容量瓶 C. 分液漏斗 D. 蒸馏烧瓶
(3)乙装置优于甲装置的理由________ (写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作为电解质,向负极充入燃料气CH4,用空气与CO2的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中,CO32-移向__极(填“正”或“负”),已知CH4发生反应的电极反应式为___,则另一极的电极反应式为___。
(2)某实验小组同学对电化学原理进行了一系列探究活动。
①如图为某实验小组依据的氧化还原反应:___(用离子方程式表示)设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过__mol电子。
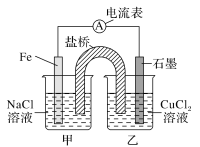
②其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨的电极反应式为___。
③如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,
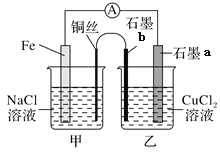
一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是___,电极反应式为___;乙装置中石墨a为___极(填“正”“负”“阴”或“阳”),乙装置中与铜丝相连石墨b电极上发生的反应式为___,产物常用___检验。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程

已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式)
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序______________。
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是____________________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是______________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
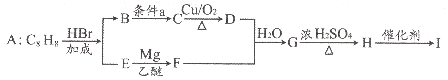
【题目】已知高分子化合物I是轻工业生产的重要原料,其中一种生产合成路线如下:
已知: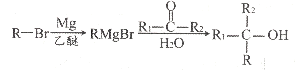
回答下列问题:
(1)A为芳香烃,A的化学名称是______。
(2)G→H、H→I的反应类型分别是______、______。
(3)若G结构为 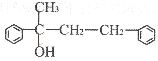
①请写出D的结构简式______。
②2由B生成C的化学方程式为__。
(4)C有多种同分异构体,其中属于酚类的同分异构体有_____种,写出其中具有四组核磁共振氢谱峰的一种结构简式_____。
(5)参考上述合成路线信息,写出以CH3-CH=CH2和CH3MgBr为原料(其它无机物任选)合成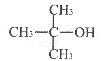 的合成路线图。_____
的合成路线图。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
实验 编号 | 温度/℃ | 平衡常数 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法中不正确的是( )
A. x=2.4
B. 实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1
C. K1、K2的关系:K2>K1
D. T1、T2的关系:T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
I.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
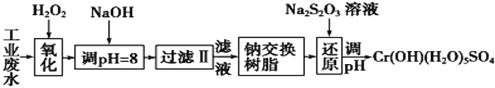
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是____(填序号);已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是____(填序号)。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗172.8gCr2O72-转移4.8 mol e-,该反应离子方程式为____。
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室用如图装置模拟处理含Cr2O72-废水,阳极反应是Fe-2e-=Fe2+,阴极反应式2H++2e-=H2↑随着电解进行,阴极附近pH升高。
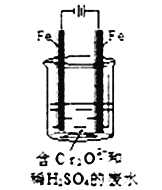
(1)电解时能否用Cu电极来代替Fe电极?____(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为________________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com