
【题目】蛋白质在胃蛋白酶和胰蛋白酶的作用下变成氨基酸的反应属于( )
A.消去反应
B.水解反应
C.取代反应
D.聚合反应
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】已知298K时,某碱MOH的电离平衡常数Kb=1.0×10-5;电离度a=![]() 。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是
。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是
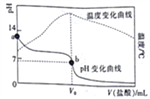
A. a点对应的溶液中:c(OH-)=(M+)+<(H+)
B. b点对应的V。=20.00mL
C. 298K时,0.1000mol/LMOH溶液中,MOH的电离度a=1%
D. 298K时,将0.1molMOH和0.1moMCl溶于水配制成1L混合溶液,溶液的pH>9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.SO2 , CO2 , SiO2中的S,C,Si均为sp3杂化
B.SO32﹣ , CO32﹣ , SiO32﹣均为平面三角形
C.H3O+ , NH4+ , [Cu(NH3)4]2+均含有配位键
D.石墨、新型高分子导电材料聚乙炔、金属晶体均含有金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
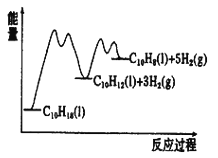
【题目】(一)十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:ΔH1>ΔH2>0
C10H18(l)![]() C10H12(l)+3H2(g) ΔH1
C10H12(l)+3H2(g) ΔH1
C10H12(l)![]() C10H8(l)+2H2(g) ΔH2
C10H8(l)+2H2(g) ΔH2
请回答:
(1)则C10H8(l)+5H2(g)![]() C10H18(l) ΔH3=___________。
C10H18(l) ΔH3=___________。
(2)有利于提高上述反应平衡转化率的条件是:___________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)研究表明,将适量十氢萘置于恒容密闭反应器中,升高温度带来高压,该条件下也可显著释氢,理由是:_______________________________。
(4)温度335℃时,在恒容密闭反应器中进行高压液态十氢萘(1.00mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间的变化关系,如下图所示。
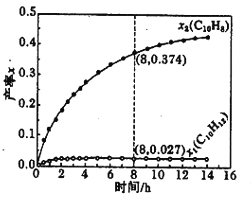
在8h时,反应体系内氢气的量为:_________ mol(忽略其他副反应)。
②已知反应过程中的能量变化如图所示,x1显著低于x2的原因是:_________________________。
(二)科学家发现,以H2O和N2为原料,熔融NaOH—KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨。
(5)阴极区发生的变化可视为按两步进行。先发生的电极反应式为:________________________,随后发生反应:2Fe+3H2O+N2==2NH3+Fe2O3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是
A. 氢气的燃烧热为-285.5 kJ/mol,则水电解的热化学方程式为:2H2O(l)=2H2(g)+O2(g) ΔH=+285.5 kJ/mol
B. lmol甲烷完全燃烧生成CO2和H2O(l)时放出890kJ热量,它的热化学方程式为: ![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g) H2O(l) △H= -445 kJ/mol
CO2(g) H2O(l) △H= -445 kJ/mol
C. 已知C(石墨,s)![]() C(金刚石,s) ΔH=+1.9kJ/mol,则金刚石比石墨稳定
C(金刚石,s) ΔH=+1.9kJ/mol,则金刚石比石墨稳定
D. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为: N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ/mol
2NH3(g) ΔH=-38.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于酶的叙述,不正确的是 ( )
A. 绝大多数酶的化学本质是蛋白质
B. 酶催化的化学反应一般是在比较温和的条件下进行的
C. 能够催化脂肪酶水解的酶是脂肪酶
D. 酶的催化效率高是因为其降低活化能的效果显著
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素(其结构如下图所示)是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是
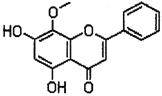
A. 汉黄芩素的分子式为C16H13O3
B. 汉黄芩素遇FeCl3溶液显色
C. lmol汉黄芩素与溴水反应,最多消耗2molBr2
D. 汉黄芩素与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月18日,中国国土资源部地质调查局宣布,我国在南海进行的可燃冰试采获得成功,成为全球第一个海域试采可燃冰成功的国家,可燃冰即天然气水合物,甲烷含量占80%至99.9%。化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇或合成氨,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g) △H1 =-36kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2 =+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,每生产lmolCO,转移电子的数目为__________。
(2)甲醇是一种用途广泛的化工原料,工业上常用下列两种反应制备甲醇:
CO(g)+2H2(g)=CH3OH(g) △H1 =-90kJ·mol-1 K1
CO2(g)+3H2(g)= CH3OH(g)+H2O(l) △H2 K2
己知:CO(g)+H2O(g)= CO2(g)+H2(g) △H3 =-41.1kJ·mol-1 K3
H2O(l)=H2O(g) △H4 =+44.0kJ·mol-1 K4
则△H2=______ K2=_______ (用含K1、K3、K4的代数式表示)
(3)在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)十3H2(g) ![]() CH3OH(g)十H2O(g)
CH3OH(g)十H2O(g)
①下列能说明该反应已达到平衡状态的是______________________。
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.容器内压强恒定不变 D.反应速率满足以下关系:V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H键的同时形成2molH-O键
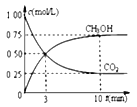
②模拟过程中测得CO2和CH3OH(g)浓度随时间变化如图所示,若此时容器内压强为P,则用平衡分压代替平衡浓度表示的化学平衡常数KP为_____________(用含P的代数式表示,数值保留两位小数),若此时再向容器内充入0.25molCO2和0.25molCH3OH的混合气体,则平衡______(填“正向“逆向“不”)移动。(已知:气体分压=气体总压×体积分数)
(4)甲醇可在电解银催化作用下制甲醛,从贵金属阳极泥中可提取“粗银”“粗银”(含Ag、Cu、Au)可用电解槽电解精炼,纯银作阴极,采用AgNO3和稀HNO3的混合液作电解液,阴极的主要电极反应式为_____。阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为_______。硝酸浓度不能过大,其原因是___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com