
【题目】工业上常用还原沉淀法处理含铬废水(Cr2O72—和CrO42—),其流程为:
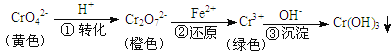
已知:步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)![]() Cr3+(aq)+3OH—(aq) Ksp=c(Cr3+)·c3(OH—)=10-32
Cr3+(aq)+3OH—(aq) Ksp=c(Cr3+)·c3(OH—)=10-32
下列有关说法不正确的是
A.步骤①中当v正(CrO42—)=2v逆(Cr2O72—)时,说明反应:2CrO42—+2H+![]() Cr2O72—+H2O达到平衡状态
Cr2O72—+H2O达到平衡状态
B.若向K2Cr2O7溶液中加NaOH浓溶液,溶液可由橙色变黄色
C.步骤②中,若要还原1 mol Cr2O72—离子,需要12 mol (NH4)2Fe(SO4)2
D.步骤③中,当将溶液的pH调节至5时,可认为废水中的铬元素已基本除尽(当溶液中c(Cr3+)≤10-5mol/L时,可视作该离子沉淀完全)
【答案】C
【解析】
A、步骤①中当v正(CrO42—)=2v逆(Cr2O72—)时,符合该反应2CrO42—+2H+![]() Cr2O72—+H2O的正逆反应速率相等,为平衡状态,A正确;
Cr2O72—+H2O的正逆反应速率相等,为平衡状态,A正确;
B、若向K2Cr2O7溶液中加NaOH浓溶液,则氢氧根离子与氢离子反应生成水,所以氢离子浓度减小,2CrO42—+2H+![]() Cr2O72—+H2O平衡逆向移动,CrO42—的浓度增大,溶液由橙色变为黄色,B正确;
Cr2O72—+H2O平衡逆向移动,CrO42—的浓度增大,溶液由橙色变为黄色,B正确;
C、步骤②中,若要还原1 mol Cr2O72—离子,则生成2molCr3+,Cr元素的化合价从+6价降低到+3价,得到6mol电子,而Fe2+被氧化为Fe3+,失去1个电子,根据得失电子守恒,需要6molFe2+,所以需要6mol (NH4)2Fe(SO4)2,C错误;
D、步骤③中,当将溶液的pH调节至5时,氢氧根离子浓度为10-9mol/L,根据Ksp=c(Cr3+)·c3(OH—)=10-32,此时c(Cr3+)=10-5mol/L,所以可认为废水中的铬元素已基本除尽,D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。
①完成本实验需要不断用玻璃棒搅拌,其目的是_______________________________。
②若实验前所称样品的质量为m g,加热至恒重时固体质量为a g,则样品中纯碱的质量分数为________。
(2)方案二:按如图所示装置进行实验,并回答下列问题:
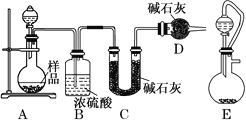
①实验前先检查装置的气密性,并称取一定质量的样品放入A中,将稀硫酸装入分液漏斗中。D装置的作用是________________。
②实验中除称量样品质量外,还需分别称量_______装置反应前、后质量(填装置字母代号)。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显的缺陷,该缺陷是_________。
④有同学认为,用E装置替代A装置能提高实验准确度。你认为是否正确?_________(填“是”或“否”)。
(3)方案三:称取一定量的样品置于锥形瓶中,加适量水,用盐酸进行滴定,从开始至有气体产生到气体不再产生,所滴加的盐酸体积如图所示,则小苏打样品中纯碱的质量分数为_________(保留两位有效数字)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将n mol·L-1氨水滴入10 mL 1.0 mol·L-1 盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是

A. a点KW=1.0×10-14
B. b点:c(NH)>c(Cl-)>c(H+)>c(OH-)
C. 25 ℃时,NH4Cl水解常数为(n-1)×10-7(用n表示)
D. d点水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是
A. CS2为V形的极性分子
B. ClO3—的空间构型为平面三角形
C. SF6中有6对相同的成键电子对
D. SiF4和SO32—的中心原子均为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得 Ce(OH)4和硫酸铁铵矾[Fe2(SO4) 3(NH4) 2SO424H2O]流程设计如下:

已知:Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;Ⅱ.CeO2不溶于稀硫酸,也不溶于 NaOH溶液。
回答以下问题:
(1)反应②中H2O2的作用是___________。
(2)反应③的离子方程式是________。
(3)已知有机物 HT 能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+ (水层)+ 6HT(有机层)![]() 2CeT3 (有机层)+ 6H+(水层),从平衡角度解释:向 CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是_______。
2CeT3 (有机层)+ 6H+(水层),从平衡角度解释:向 CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是_______。
(4)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是___________。
(5)用滴定法测定制得的 Ce(OH)4 产品纯度。
![]()
若所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4 产品的质量分数____。(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素碳、氧、氮、氟、磷、硒及副族元素镍、铜元素在化学中有很重要的地位,回答下列问题:
(1)在基态14C原子中,核外存在___对自旋相反的电子,基态氮原子的价层电子排布图为____。
(2)将F2通入稀NaOH溶液中可生成OF2,OF2分子构型为__其中氧原子的杂化方式为_______。
(3)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产生活中具有重要的作用。
(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)___。
(2)铝电池性能优越,在现代生产、生活中有广泛的应用。铝—空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
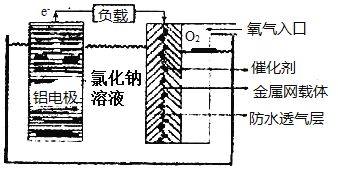
该电池的正极反应方程式为___,当铝电极质量减少9克,则另一极通入的氧气的体积在标准状况下为___。
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2。写出反应化学方程式为___。
(4)在元素周期表中,砷位于铝的下一周期,与氮元素同主族,写出AsH3分子的电子式为___,相同压强下,AsH3的沸点___NH3(填“大于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.按系统命名法,化合物![]() 的名称为2﹣甲基﹣3,4﹣二乙基己烷
的名称为2﹣甲基﹣3,4﹣二乙基己烷
B.等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小
C.下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3
D.![]() 与
与![]() 互为同系物
互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com