某校化学研究性学习小组查阅资料了解到以下内容:乙二酸(HOOC-COOH,可简写为H
2C
2O
4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华并开始分解.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO
3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为
.
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO
4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有
(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
MnO
4-+
H
2C
2O
4+
H
+=
Mn
2++
CO
2↑+
H
2O
(3)将一定量的乙二酸放于试管中,按如图所示装置进行实验探究其分解产物(注:忽略草酸的升华,且夹持装置未标出):

图中有一处错误,应如何改正?
.
用改正后的装置做实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO
4粉末变蓝,F中CuO粉末由黑色变为红色.据此回答:上述装置中,D的作用是
.乙二酸分解的化学方程式为
.
(4)该小组同学将2.52g草酸晶体(H
2C
2O
4?2H
2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性(忽略溶液体积变化).则下列关系合理的是
A.c(Na
+)+c(H
+)=c(HC
2O
4-)+c(OH
-)+c(C
2O
42-)
B.c(HC
2O
4-)+c(C
2O
42-)=0.2mol?L
-1C. c(HC
2O
4-)>c(C
2O
42-)>c(H
2C
2O
4)
D.c(Na
+)=c(H
2C
2O
4)+c(HC
2O
4-)+c(C
2O
42-)




 一线名师权威作业本系列答案
一线名师权威作业本系列答案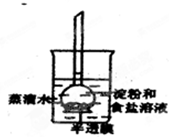 如图所示,烧杯内装有蒸馏水,下部封有半透膜的长颈漏斗内装有淀粉和食盐溶液,漏斗颈内的液面略高于烧杯内蒸馏水的液面,过一段时间后用碘水和硝酸银溶液分别检验蒸馏水中的物质.整个实验过程中,所观察到的现象是( )
如图所示,烧杯内装有蒸馏水,下部封有半透膜的长颈漏斗内装有淀粉和食盐溶液,漏斗颈内的液面略高于烧杯内蒸馏水的液面,过一段时间后用碘水和硝酸银溶液分别检验蒸馏水中的物质.整个实验过程中,所观察到的现象是( )
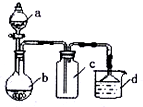 实验室某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).用此装置和表中提供的物质完成相关实验,最合理的选项是( )