
| ||
| 0.2 |
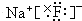 ;
;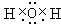 ;
;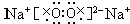 ,
,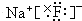 ,含有离子键,属于离子晶体;
,含有离子键,属于离子晶体;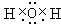 ,含有共价键,属于分子晶体;
,含有共价键,属于分子晶体;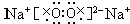 ,含有离子键、共价键,属于离子晶体.
,含有离子键、共价键,属于离子晶体.

科目:高中化学 来源:不详 题型:单选题
| A.碘和干冰的升华 |
| B.二氧化硅和生石灰的熔化 |
| C.氯化钠和铁的熔化 |
| D.苯和己烷的蒸发 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
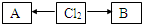 ,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式______;C与B的组成元素相同,C中氯元素的化合价为最高价,C与H2SO4相比,酸性强的是______(填化学式).
,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式______;C与B的组成元素相同,C中氯元素的化合价为最高价,C与H2SO4相比,酸性强的是______(填化学式).查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X与Y不可能形成XY型化合物 |
| B.X与Y的离子最外层电子数可能相等 |
| C.X与Y不可能位于同一主族 |
| D.X与Y一定位于同一周期 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 7 |
| 8 |
| A.Y单质可与Z的氢化物的水溶液反应,使溶液pH减小 |
| B.最高价氧化物的水化物酸性:W>Z |
| C.原子半径由大到小的排列顺序是:Z>Y>X |
| D.X的单质中有一种为白色蜡状固体 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 元素 | 有关信息 |
| X | 在自然界中原子半径最小 |
| Y | 最外层电子数是次外层的2倍 |
| Z | 元素的主要化合价为-2价 |
| M | 其单质及其化合物的焰色为黄色 |
| N | 与Y同主族,其单质为半导体材料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com