
【题目】科学家发现一种细菌在两种酶的帮助下,能够“切割”聚对苯二甲酸乙二酯(![]() )塑料得到单体对苯二甲酸和乙二醇。下列说法正确的是( )
)塑料得到单体对苯二甲酸和乙二醇。下列说法正确的是( )
A.单体间通过加聚反应合成PET
B. PET能与Br2发生加成反应
C.细菌“切割”PET塑料的过程是一个物理过程
D.细菌“切割”PET塑料的优势是条件温和
科目:高中化学 来源: 题型:
【题目】S-诱抗素可保证盆栽鲜花盛开,其分子结构如图,下列说法不正确的是

A. 该物质的分子式为C15H20O4 B. 该物质环上的二氯代物只有2种
C. 1mol该物质最多能与2 mol NaOH完全反应 D. 该物质能发生取代、加成、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线型结构![]() 。有机物A的键线式结构为
。有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A,下列有关说法错误的是
,有机物B与等物质的量的H2发生加成反应可得到有机物A,下列有关说法错误的是
A.有机物A的一氯代物只有5种
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的分子式为C8H16
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种钠空气水电池的充、放电过程原理示意图如图所示,下列有关说法错误的是
■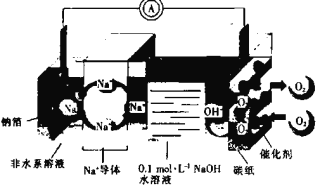
A.放电时,Na+向正极移动
B.放电时,电子由钠箔经过导线流向碳纸
C.充电时,当有0.1mole-通过导线时,则钠箔增重2.3g
D.充电时,碳纸与电源负极相连,电极反应式为4OH--4e=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高分子化合物![]() 的结构简式如下:
的结构简式如下:
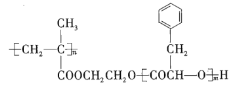
下列有关![]() 的说法正确的是( )
的说法正确的是( )
A.![]() 的一种单体的分子式可能为
的一种单体的分子式可能为![]()
B.![]() 完全水解后的生成物均为小分子有机物
完全水解后的生成物均为小分子有机物
C.可以通过加聚反应和缩聚反应合成![]()
D.碱性条件下,![]() 完全水解消耗NaOH的物质的量为
完全水解消耗NaOH的物质的量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示。下列关于该有机物的说法正确的是( )
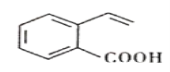
A.该有机物能发生酯化、加成、氧化、水解等反应
B.该有机物中所有碳原子不可能处于同一平面上
C.与该有机物具有相同官能团的同分异构体有3种
D.1mol该有机物最多与4molH2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题是广大群众关注的热点话题之一,化工厂排放的废水、废渣一般利用化学原理可以进行排放物达标检测与无害化处理。某皮革厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
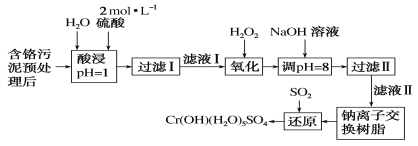
已知:①酸浸后的溶液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4 | 9 |
沉淀溶解时的pH | — | — | >8溶解 | >9溶解 |
(1)如需配制480 mL酸浸环节所需的硫酸,需要用量筒量取18.4 mol·L-1的浓硫酸____mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需哪些仪器_____。
(2)经氧化环节滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:________。
(3)调pH=8环节,既可以将溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O72-转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请解释该颜色变化的原因_______。
(4)钠离子交换树脂的反应原理为Mn++nNaRMRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有________。
(5)请写出流程中用SO2进行还原时发生反应的离子方程式:______________。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
①滴定时可选为滴定指示剂的是________(填编号),
A.NaCl B.K2CrO4 C.KI D.NaCN
②如何确定该滴定过程的终点:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是( )
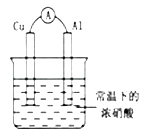
A.Cu是原电池的负极
B.Al是原电池的负极
C.电子由Al沿导线流向铜
D.铝片上的电极反应式为:Al﹣3e﹣═AL3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点

(1)在100℃时,Kw表达式为_______,在此温度下,kw为___.
(2)在室温下,将pH=9的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7则Ba(OH)2与盐酸的体积比为____.
(3)室温时将PH为3的硫酸溶液稀释100倍,稀释后溶液中,C(SO42-)和C(H+)之比约为___.
II.今有①CH3COOH ②HCl ③H2SO4三种溶液.根据要求回答下列问题:
(1)写出①的电离方程式_______.
(2)当它们pH相同时,其物质的量浓度最大的是___(填序号).
(3)当它们的物质的量浓度相同时,其pH最小是___(填序号).
(4)在室温下,将c(H+)均为0.01mol/L的三种酸分别加水稀释至原来的10倍,c(H+)由大到小的顺序为___(填序号).
(5)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为____.
(6)三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为___(填序号).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com