
【题目】下列说法中正确的是
A.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃的条件下△H不相同
B.化学反应中的能量变化都表现为热量变化
C.任何放热反应在常温下都能发生
D.化学反应的反应热可通过反应物的键能之和减去生成物的键能之和求得
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】从含铜废料(如:覆铜板、印刷线路板及铅冰铜等)中提取铜,既可提高资源的利用率又可减少重金属污染。
(1)废覆铜板(Cu和Sn组成)可用CuSO4和H2SO4混合溶液作电解质溶液,直接电解回收精铜,阳极上发生的电极反应为 。
(2)废印刷线路板中的铜常用含盐酸的FeCl3溶液或H2O2-HCl- NaCl混合溶液浸取回收。
①用FeCl3溶液浸取铜时发生反应的离子方程式为 ;若加盐酸不足,反应一段时间后线路板表面有红褐色沉淀,产生红褐色沉淀的原因是 。
②将粉碎后的废印刷线路板放入三口烧瓶中,分别加入由0.3mol·L-1盐酸、0.5mol·L-1NaCl及不同浓度的H2O2组成的混合溶液,在温度、搅拌速率及固液比等均相同时,铜的浸取率随H2O2的浓度和时间的变化如图-1所示。当c(H2O2)= 0 mol·L-1时,也有少量的铜被浸出,其原因是 。
③用H2O2-HCl- NaCl混合溶液浸取时,其浸取过程包括:
(Ⅰ)Cu+H2O2+2H+=Cu2++2H2O
(Ⅱ)Cu2++Cu![]() 2Cu+
2Cu+
(Ⅲ)Cu++nCl-![]() CuCln(n-1)-
CuCln(n-1)-
(Ⅳ)2CuCln(n-1)-+2H++H2O2=2Cu2++2H2O+2nCl-
其他条件相同时,增大下列离子浓度可以加速Cu从废电路板中浸出的是 (填序号)。
a.Na+ b.Cu2+ c.Cl- d.OH-

(3)铅冰铜(PbS、Cu2S及FeS的混合物)可用HCl-H2O2混合溶液浸取。
①Cu2S被HCl-H2O2混合溶液浸取得到硫酸铜和氯化铜溶液的化学方程式为 。
②若由H2SO4代替HCl-H2O2中的HCl,其他条件相同,铜的浸取率随硫酸浓度的变化如图-2所示。当H2SO4浓度大于3.1mol·L-1时,硫酸浓度越大,铜的浸取率反而越小,其原因可能是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 mol白磷完全转化为红磷放出29.2 kJ热量,下列两个反应:P4(白,s)+5O2(g)=2P2O5(s)ΔH=-Q1,4P(红,s)+5O2(g)=2P2O5(s)ΔH=-Q2,Q1与Q2的关系是
A.Q1=Q2 B.Q1<Q2 C.Q1>Q2 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应∶2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是
2NO+O2在密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2 的同时,生成2n mol NO ③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥ 混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.2 mol水的摩尔质量和1 mol水的摩尔质量
B.200 mL 1 mol/L氯化钙溶液中c(Cl-)和100 mL 2 mol/L氯化钾溶液中c(Cl-)
C.64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,C(s)+H2O(g)![]() CO(g)+H2(g) 不能自发进行,则该反应的ΔH>0
CO(g)+H2(g) 不能自发进行,则该反应的ΔH>0
B.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
D.常温下,在0.1 mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,密闭容器中充入一定物质的量的NO2 和SO2 ,发生如下反应: NO2+ SO2![]() NO + SO3 ,达到平衡时,下列叙述正确的是
NO + SO3 ,达到平衡时,下列叙述正确的是
A、 SO2 、NO2、NO、SO3 的物质的量一定相等
B、 NO2和 SO2 的物质的量一定相等
C、平衡体系中反应物的总物质的量一定等于生成物的总物质的量
D、NO 和 SO3 的物质的量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向一带活塞的密闭容器中充入2molA和1molB,发生下列反应:2A(g)+B(g)![]() 2C(g) △H< 0,达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图。下列对t1时刻改变条件的推测中正确的是
2C(g) △H< 0,达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图。下列对t1时刻改变条件的推测中正确的是
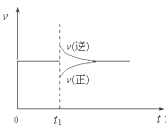
A、保持压强不变,升高反应温度
B、保持温度不变,增大容器体积
C、保持温度和容器体积不变,充入1molC(g)
D、保持温度和压强不变,充入1molC(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法中,正确的是
①常温下,15g甲醛(![]() )中含有的共用电子对总数为2NA
)中含有的共用电子对总数为2NA
②常温常压下,18gD2O中含有的电子总数为10NA
③将l00mL0.1mol·L-1的FeCl3溶液滴入沸水中,可制得Fe(OH)3胶粒0.0lNA.
④在反应KIO3+6HI===KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA
⑤电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜
⑥1.7g的羟基与1.7g的氢氧根离子所含电子数均为0.9NA
A.①④
B.③④
C.②⑥
D.②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com