
| A. | 禁止或少放烟花炮竹、绿色出行可缓解雾霾天气的形成 | |
| B. | 在制作腊肉或香肠时,可加入过量的亚硝酸钠以保持肉类新鲜 | |
| C. | “地沟油”禁止食用,但处理后可用来制肥皂和生物柴油 | |
| D. | 盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可降低土壤的碱性 |
分析 A.燃放烟花炮竹,可导致雾霾;
B.过量亚硝酸钠对人体有害;
C.地沟油对人体有害,可用于制备肥皂和生物柴油;
D.Na2CO3水解呈碱性.
解答 解:A.燃放烟花炮竹,可导致雾霾,禁止或少放烟花炮竹,可减少雾霾,故A正确;
B.过量亚硝酸钠对人体有害,生成的亚硝胺可致癌,应适量,故B错误;
C.地沟油对人体有害,属于油脂,可用于制备肥皂和生物柴油,故C正确;
D.Na2CO3水解呈碱性,施加适量石膏,生成碳酸钙,可降低土壤的碱性,故D正确.
故选B.
点评 本题考查较为综合,涉及环保、食品添加剂等知识,为高考常见题型和高频考点,侧重化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
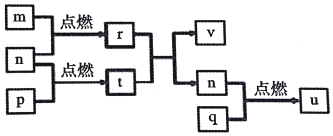 短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小:W>Z>Y>X | |
| B. | Z分别与Y、W组成的化合物中化学键类型可能相同 | |
| C. | v能抑制水的电离而u能促进水的电离 | |
| D. | 粘有q的试管可用酒精洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
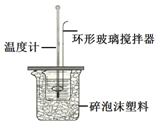 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| HCl | NaOH | ||
| 1 | 26.1 | 26.1 | 29.3 |
| 2 | 25.9 | 25.9 | 29.0 |
| 3 | 26.3 | 26.3 | 29.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(B)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 前50s内B的平均反应速率v(B)=0.0032mol•L-1•s-1 | |
| B. | 相同温度下,若达平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大 | |
| C. | 相同温度下,若起始时向容器中充入1.0mol A、0.20mol B和0.20mol C,则达到平衡前 v(正)>V(逆) | |
| D. | 若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2mol.L-1,则反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 酸 | HClO2 | H2CO3 | HClO |
| Ka | 1×10-2 | K1=4.3×10-7、K2=5.6×10-11 | 3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2的燃烧热为285.8 kJ•mol-1,则表示H2燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 中和热为57.3 kJ•mol-1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知:C(s,金刚石)+O2(g)═CO2(g)△H=-395.4 kJ•mol-1,C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.9 kJ•mol-1 | |
| D. | 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨可用作制冷剂是因为其气化时可放出大量的热 | |
| B. | 将青蒿在乙醚中浸取,通过分馏可提取治疗疟疾的青蒿素 | |
| C. | 钢制品、铝制品在日常生活中被广泛应用是因为铁、铝为活泼金属 | |
| D. | 久置的漂白粉变质是因为漂白粉与空气中的O2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学性质 | 实际应用 |
| A | ClO2具有强氧化性 | 自来水消毒杀菌 |
| B | SO2具有还原性 | 用作漂白剂 |
| C | NaHCO3受热易分解并且生成气体 | 焙制糕点 |
| D | Al(OH)3分解吸收大量热量并有H2O生成 | 阻燃剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com