
【题目】电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 
(1)若X,Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则 电解池中Y极上的电极反应式为 . 在X极附近观察到的现象是 .
(2)若X,Y都是惰性电极,a是CuSO4溶液,X电极上的电极反应式为 , 在X极附近观察到的现象是 .
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是 , 电极反应式是 .
【答案】
(1)2Cl﹣﹣2e﹣=Cl2↑;生成无色气体,
(2)Cu2++2e﹣=Cu;有红色物质生成
(3)精铜;Cu2++2e﹣=Cu
【解析】解:(1)和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl﹣﹣2e﹣=Cl2↑,和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e﹣=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,生成无色气体,滴入几滴酚酞试液会变红,所以答案是:2Cl﹣﹣2e﹣=Cl2↑;生成无色气体,溶液变红;(2)用惰性电极电解硫酸铜溶液时,X电极为阴极,阴极上铜离子放电生成Cu,Cu2++2e﹣=Cu,所以在X极附近观察到的现象是有红色物质生成,所以答案是:Cu2++2e﹣=Cu;有红色物质生成;(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极应该是粗铜、阳极发生反应为:Cu﹣2e﹣=Cu2+ , 阴极是纯铜,则X电极是精铜、Y电极是粗铜,阴极上铜离子放电,电极反应式为Cu2++2e﹣=Cu,所以答案是:精铜; Cu2++2e﹣=Cu.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】对于某些离子的检验及结论一定正确的是
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.A、B、C、D是中学化学常见的混合物分离或提纯的基本装置。
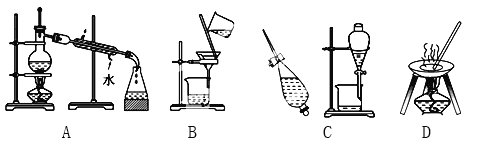
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪一种装置,将A、B、C、D填入适当的空格中。
(1)从碘水中提取碘_____________________________;
(2)实验室制取蒸馏水_____________________________;
(3)去粗盐中的泥沙_____________________________;
(4)与海水晒盐原理相符的是___________________________。
Ⅱ.现有下列八种物质:①HCl气体②Cu ③CO ④CO2 ⑤金刚石 ⑥KMnO4固体 ⑦Ba(OH)2溶液 ⑧熔融KAl(SO4)2
(1)属于单质的是_________;属于酸性氧化物的是_________;所给状态能导电的电解质是_________;(填所给物质的序号)
(2)写出Ba(OH)2在水中的电离方程式:____________________________________________;
(3)用双线桥表示该反应中电子转移的方向和数目_______
2KMnO4+16HCl=5Cl2↑+2MnCl2+2KCl+8H2O
若有0.8mol还原剂被氧化,则转移电子的物质的量是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,气体摩尔体积约为22.4L·mol-1,则标准状况下0.5mol氢气的体积约为( )
A. 0.5 LB. 5 LC. 11.2 LD. 22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,水槽中试管内有一枚铁钉,放置数天观察: 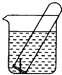
①铁钉在逐渐生绣.
②若试管内液面上升,发生腐蚀,正极: .
③若试管内液面下降,则原溶液呈性,正极: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需0.1mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl的质量分别是
A.1000mL,5.85gB.950mL,5.6gC.1000mL,5.9gD.500mL,2.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铝土矿的主要成分是Al2O3,含有杂质SiO2(不溶于盐酸和水)、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:
请回答下列问题:
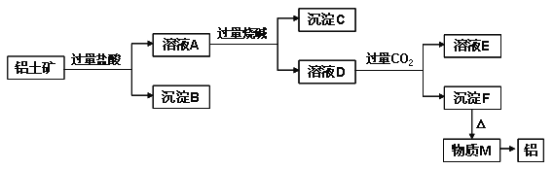
(1)溶液A转化为溶液D发生的离子方程式为________________________________。
(2)由物质M制取铝的化学方程式为________________________________________。
(3)溶液D中通入过量CO2生成沉淀F的离子方程式为________________________。
(4)沉淀C的成分是____________ ,逐滴向少量沉淀C中加入过量盐酸至沉淀全部溶解,此过程的实验现象为_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com