
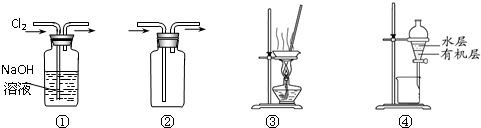
| A、装置①可用于除去Cl2中含有的少量HCl气体 |
| B、按装置②所示的气流方向可用于收集H2、NH3等 |
| C、用图③所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| D、用图④所示装置分离CCl4萃取碘水后已分层的有机层和水层 |


科目:高中化学 来源: 题型:
| ||
| 高温 |

| 充电 |
| 放电 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验现象 | 硫酸所表现的性质或特性 |
| 敞口放置浓硫酸时,质量增加 | |
| 锌粒放入稀硫酸中时,有气体放出 | |
| 把木屑放入浓硫酸中时,变黑 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 原因 | 结果 |
| A | 汽车尾气的大量排放 | 光化学烟雾 |
| B | SO2和NO2气体大量排放 | 酸雨 |
| C | 含氮、磷等生活废水的大量排放 | 水体富营养化 |
| D | 大量植树造林 | 温室效应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| B、实验室盛碱液的瓶子不用玻璃塞:SiO2+2OH-═SiO32-+H2O |
| C、用稀盐酸和大理石反应制取CO2:CO32-+2H+═CO2↑+H2O |
| D、向Ca(ClO)2溶液中通入过量CO2制取次氯酸:2ClO-+H2O+CO2═2HClO+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.下列有关说法不正确的是( )
H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.下列有关说法不正确的是( )| A、在pH=13时,溶液中主要含磷物种浓度大小关系为c(HPO42-)>c(PO43-) |
| B、为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 |
| C、在pH=7.2时,HPO42-、H2PO4-的分布分数各为0.5,则H3PO4的Ka2=10-7.2 |
| D、Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6种 | B、9种 |
| C、12种 | D、15种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 能源问题是当代社会面临的重大课题,甲醇是未来的重要能源物质.合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g).
能源问题是当代社会面临的重大课题,甲醇是未来的重要能源物质.合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com