
| 39g |
| 78g/mol |
| 1.5mol |
| 0.5L |
| 3.5mol |
| 0.5L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、H+、C1-、CO32-、K+ |
| B、NH4+、OH-、Cl-、Na+ |
| C、Na+、NO3-、C1-、K+ |
| D、Ag+、NO3-、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、回收其中的石墨电极 |
| B、防止电池中渗泄的电解液腐蚀其他物品 |
| C、利用电池外壳的金属材料 |
| D、防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 杂质 | 所选试剂 | 离子方程式 |
| NaCl溶液 | Na2CO3 | ||
| Mg粉 | Al 粉 | ||
| FeCl2溶液 | FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
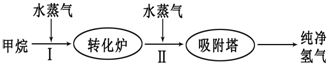

| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
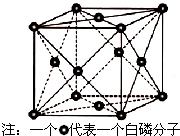 VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题.
VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某充电电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.下列对此电池叙述正确的是
某充电电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.下列对此电池叙述正确的是| A、放电过程中,左槽溶液颜色由黄色变为蓝色 |
| B、充电过程中,a极的反应式为:VO2++2H++e-=VO2++H2O |
| C、充电时,b极接直流电源正极,a极接直流电源负极 |
| D、放电时,当转移1.0 mol电子时共有2.0 mol H+从右槽迁移进左槽 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com