

分析 (1)①②猜想其产物为CO、CO2和H2O,草酸在100℃时开始升华,157℃时大量升华,并开始分解.草酸钙不溶于水、草酸蒸气能使澄清石灰水变浑浊、草酸蒸气在低温下可冷凝为固体,分析可知先冷凝挥发出的草酸,再检验水蒸气的生成,检验二氧化碳的生成,并除去二氧化碳,再通过灼热的氧化铜检验一氧化碳气体的存在,利用反应后生成的二氧化碳通入澄清石灰水变浑浊证明一氧化碳的存在;
③检验产物中CO的实验现象是C中黑色氧化铜变红色,生成了澄清石灰水变浑浊的气体;
④一氧化碳有毒,会污染空气,需要吸收处理装置;
(2)没有480mL的容量瓶,只能选用500mL的容量瓶,根据m=cVM来解答;
(3)A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色,说明草酸具有酸性;
B.测定0.1molL-1草酸溶液的pH,根据氢离子浓度和草酸浓度相对大小判断电解质强弱;
C.将草酸溶液加入Na2CO3溶液中,有CO2放出,说明草酸酸性大于碳酸;
D.测定草酸钠溶液的pH,根据溶液酸碱性判断草酸酸性强弱;
(4)二者恰好反应生成NaHC2O4,混合溶液呈酸性,则c(H+)>c(OH-),Na+不水解、HC2O4-水解,则c(Na+)>c(HC2O4-),溶液呈酸性说明HC2O4-电离程度大于水解程度,据此判断离子浓度大小;
(5)酸性条件下,KMnO4具有强氧化性,酸性KMnO4溶液和草酸发生氧化还原反应,溶液褪色,Mn元素化合价由+7价变为+2价,则C元素生成稳定氧化物CO2,根据转移电子相等、原子守恒、电荷守恒书写离子方程式;
(6)①计算出配制的100mL样品溶液会消耗高锰酸钾溶液的体积,再根据n=cV计算出消耗高锰酸钾的物质的量,然后根据反应2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O计算出样品中含有草酸钙的物质的量,最后计算出样品中草酸钙的质量分数;
②测定结果偏高,说明消耗的酸性高锰酸钾溶液体积偏大,如果不考虑操作引起的误差,则说明溶液中可能含有其它还原性的物质.
解答 解:(1)①分解产物为CO2、CO和H2O,草酸晶体(H2C2O4•2H2O)在100℃时开始升华,157℃时大量升华并开始分解,草酸蒸气在低温下可冷凝为固体,所以生成的气体中含有草酸蒸气,应该检验生成产物成分时除去草酸,因为检验二氧化碳需要氢氧化钙溶液,溶液中含有水分,所以要先用无水硫酸铜检验水蒸气;用CuO检验CO,CO生成二氧化碳,为防止CO生成的CO2干扰产物中CO2的检验,所以要先检验CO2、后检验CO,用B冷却得到草酸晶体、用C氧化CO、用D检验水、用E干燥CO、用F吸收二氧化碳、用G检验二氧化碳,所以其排列顺序是A→B→D→G→F→E→C→G,故答案为:D;G;
②冰水混合物的作用是除去产物中草酸蒸气,防止干扰实验,
故答案为:除去草酸蒸气,防止干扰实验;
③CO具有还原性,能还原CuO生成Cu,生成的二氧化碳能使澄清石灰水变浑浊,则能证明含有CO的现象是:黑色固体变成红色,且澄清的石灰水变浑浊,
故答案为:黑色固体变成红色,且澄清石灰水变浑浊;
④CO有毒,不能直接排空,要有尾气处理装置,
故答案为:没有CO尾气处理装置;
(2)配制480mL0.1mol•L-1的草酸溶液需要500mL容量瓶,则需要草酸晶体质量m=cVM=0.1mol/L×0.5L×126g/mol=6.3g,
故答案为:6.3;
(3)A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色,说明草酸具有酸性,但不能说明草酸部分电离,不能证明草酸是弱酸,故A错误;
B.测定0.1molL-1草酸溶液的pH,如果溶液中氢离子浓度小于草酸浓度的2倍,就说明草酸部分电离为弱电解质,故B正确;
C.将草酸溶液加入Na2CO3溶液中,有CO2放出,说明草酸酸性大于碳酸,但不能说明草酸部分电离,不能证明草酸是弱酸,故C错误;
D.测定草酸钠溶液的pH,如果草酸钠是强酸强碱盐,溶液呈中性,如果草酸钠是弱酸强碱盐,溶液呈碱性,能证明草酸是否是弱电解质,故D正确;
故答案为:B;D;
(4)二者恰好反应生成NaHC2O4,混合溶液呈酸性,则c(H+)>c(OH-),Na+不水解、HC2O4-水解,则c(Na+)>c(HC2O4-),溶液呈酸性说明HC2O4-电离程度大于水解程度,所以溶液中c(H+)>c(C2O42-),溶液呈酸性则c(OH-)浓度最小,则溶液中离子浓度大小顺序是c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(5)酸性条件下,KMnO4具有强氧化性,酸性KMnO4溶液和草酸发生氧化还原反应,溶液褪色,Mn元素化合价由+7价变为+2价,则C元素生成稳定氧化物CO2,根据转移电子相等、原子守恒、电荷守恒可得离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(6)②配制的100mL样品溶液会消耗高锰酸钾溶液的体积为VmL×$\frac{100mL}{25mL}$=4VmL,消耗高锰酸钾的物质的量为:0.0100mol•L-1×4V×10-3L=4V×10-5mol,根据反应2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可知,mg样品中含有草酸钙的物质的量为:4V×10-5mol×$\frac{5}{2}$=V×10-4mol,菜中草酸钙的质量分数为:$\frac{88g/mol×V×1{0}^{-4}mol}{mg}$×100%=$\frac{0.88V}{m}$%,
故答案为:$\frac{0.88V}{m}$%;
③用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液结果可能偏高,如果不考虑操作引起的误差,则溶液中可能含有其他还原性物质会消耗高锰酸钾,导致测定结果偏高,
故答案为:溶液中可能含有其他还原性物质会消耗高锰酸钾.
点评 本题考查性质实验方案设计,题目难度中等,涉及氧化还原反应、离子浓度大小比较、弱电解质的判断、溶液配制、实验操作先后顺序判断等知识点,明确物质的性质及实验原理是解本题关键,难点是物质检验先后顺序,易错点是(2)的计算,注意应该配制500mL溶液而不是480mL溶液.


科目:高中化学 来源: 题型:选择题

| A. | 有MnO2条件下的反应曲线是a曲线 | |
| B. | a曲线变为b曲线,反应的活化分子百分数增大 | |
| C. | a曲线变为b曲线,平衡时H2O2的转化率增大 | |
| D. | b曲线的热化学方程式为:H2O2(l)═H2O(l)+$\frac{1}{2}$O2(g)△H=-(E1-E2)KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
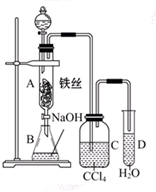 某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可发生反应生 成溴苯和溴化氢,此反应为 放热反应.他们用如图所示 装置制取溴苯.已知:溴蒸气为红棕色
某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可发生反应生 成溴苯和溴化氢,此反应为 放热反应.他们用如图所示 装置制取溴苯.已知:溴蒸气为红棕色 ,观察到A中的现象反应混合液微沸,有红棕色气体充满A容器.实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴,写出有关反应的化学方程式Br2+2NaOH═NaBr+NaBrO+H2O.
,观察到A中的现象反应混合液微沸,有红棕色气体充满A容器.实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴,写出有关反应的化学方程式Br2+2NaOH═NaBr+NaBrO+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在实验室里可以用如下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质(固定装置略去).图中①为制取氯气的装置;②试管中装有15mL30%KOH溶液,并置于热水中,制取氯酸钾;③试管中装有15mL 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液.
在实验室里可以用如下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质(固定装置略去).图中①为制取氯气的装置;②试管中装有15mL30%KOH溶液,并置于热水中,制取氯酸钾;③试管中装有15mL 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液.| 实验现象 | 原因 |
| 溶液最初从紫色变为红色 | 氯气与水反应生成的HCl使石蕊试液变红 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成HClO具有漂白性 |
| 最后溶液从无色逐渐变为浅黄绿色 | 过量氯气溶解于水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8 | B. | C3H6 | C. | C3H4 | D. | C4H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂只有锂 | |
| B. | 标准状况下生成1.12LSO2时,反应转移电子为0.1mol | |
| C. | 氧化产物包括LiCl和SO2 | |
| D. | SOCl2中既有离子键,也有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com