
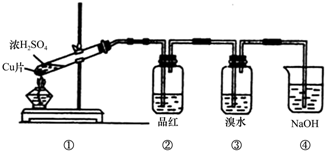
| 编号 | ① | ② | ③ | ④ |
| 装置 | 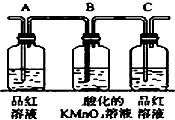 |  |  |  |
分析 碳和浓硫酸在加热条件下反应生成SO2、CO2和水,检验二氧化碳和二氧化硫时用到的溶液中均含有水,首先用无水硫酸铜检验产物水,SO2和CO2均能使澄清石灰水变浑浊,故应先用B中品红溶液检验二氧化硫,后用澄清石灰水检验二氧化碳,在用澄清石灰水检验CO2之前必须把SO2吸收干净,酸性高锰酸钾溶液用于吸收SO2,C中品红溶液用于检验SO2是否除干净,
(1)在加热条件下,C和浓硫酸发生氧化还原反应生成CO2、SO2、H2O;
(2)检验二氧化碳和二氧化硫时用到的溶液中均含有水,所以先检验水的存在,二氧化碳和二氧化硫均可以使澄清石灰水变浑浊,所以先检验二氧化硫,再除去,最后检验二氧化碳;
(3)根据实验目的和装置图考虑操作步骤和试剂的作用及发生反应,从整体考虑,A为检验二氧化硫装置,B、C为除去二氧化硫并检验是否除尽二氧化硫的装置;
(4)根据实验目的知,还要检验水蒸气,水蒸气能使无水硫酸铜变蓝,根据生成物的性质确定无水硫酸铜的位置;
(5)CO2能使澄清石灰水变浑浊,所以在排除SO2的条件下可以用澄清石灰水检验CO2.
解答 解:碳和浓硫酸在加热条件下反应生成SO2、CO2和水,检验二氧化碳和二氧化硫时用到的溶液中均含有水,首先用无水硫酸铜检验产物水,SO2和CO2均能使澄清石灰水变浑浊,故应先用B中品红溶液检验二氧化硫,后用澄清石灰水检验二氧化碳,在用澄清石灰水检验CO2之前必须把SO2吸收干净,酸性高锰酸钾溶液用于吸收SO2,C中品红溶液用于检验SO2是否除干净.
(1)在加热条件下,C和浓硫酸发生氧化还原反应生成CO2、SO2、H2O,反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(2)由上述分析可知,装置的连接顺序(按产物气流从左到右的方向)是:④→②→①→③,
故答案为:④;②;①;③;
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是:检验产物中的SO2,B瓶溶液的作用是:将SO2全部氧化吸收,C瓶溶液的作用是:确定产物中SO2已被B瓶溶液全部氧化,
故答案为:验证产物中是否有SO2;将SO2全部氧化吸收;确定产物中SO2已被B瓶溶液全部氧化;
(4)装置②是检验水的生成,可以通过无水硫酸铜是否变蓝来检验水的产生,由于产物气流通过①、③时会带出水蒸气,所以②必须在①、③之间;
故答案为:无水硫酸铜(或变色硅胶);水蒸气;产物气流通过①、③时会带出水蒸气,所以②必须在①、③之间;
(5)CO2能使澄清石灰水变浑浊,所以在排除SO2的条件下可以用澄清石灰水检验CO2,所以③中所盛溶液澄清石灰水,验证的物质是CO2,
故答案为:澄清石灰水;CO2.
点评 本题考查了浓硫酸性质实验、物质检验、实验方案设计与评价,侧重于物质的检验原理的考查,注意理解物质检验顺序,是对学生综合能力的考查,难度中等,


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入少量W,逆反应速率增大 | |
| B. | 因正反应吸热,所以升高温度正反应速率加快,逆反应速率减慢 | |
| C. | 当v(X)=v(Z)时,反应达到平衡 | |
| D. | 混合气体的密度不变时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可利用该反应进行人工固氮 | |
| B. | 将3mol N2(g)和3mol H2(g)混合,在高温、高压和催化条件下充分反应,放出热量92.22kJ | |
| C. | 因为反应需要加热,所以反应放出热量 | |
| D. | 其他条件相同时,采用更高效的正催化剂,既能提高反应速率,又能增大反应放热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由“C(石墨)═C(金刚石)△H=1.9 kJ•mol”可知,金刚石比石墨稳定 | |
| C. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| D. | 在稀溶液中:H++OH-═H2O△H=-57.3 kJ•mol,若将含1 mol H2SO4与含2 mol NaOH的溶液混合,放出的热量等于114.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 溶解性 | 沸点 | 密度(g/mL) | |
| 乙醇 | 与水互溶 | 78.5 | 0.8 |
| 溴乙烷 | 难溶于水 | 38.4 | 1.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2022 kJ | B. | 2670 kJ | C. | 1698kJ | D. | 2346 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X是负极 | B. | Y是正极 | C. | Y极发生还原反应 | D. | Y极发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com