
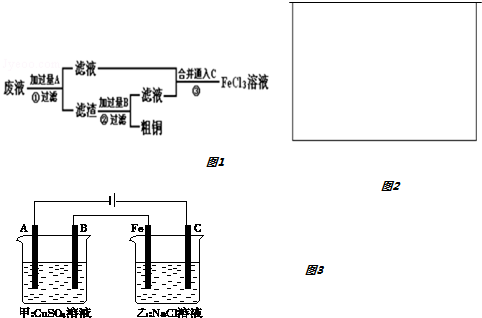
分析 腐蚀废液中含有氯化铜、氯化亚铁,加入过量的铁可以和氯化铜反应生成金属铜和氯化亚铁,故A为Fe,经①所得滤液是氯化亚铁,滤渣是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入过量B为盐酸可以将铜分离,得到的滤液为氯化亚铁,滤液合并后通入氯气,能将亚铁离子氧化为三价铁,以此(1)(2);
(3)图示是两个串联的电解池,依据电源判断A为阴极,B为阳极,Fe为阴极,C为阳极;
①电解硫酸铜溶液生成铜、阳极和硫酸,电解氯化钠溶液生成氯气、氢气和氢氧化钠;
②甲池是精炼铜,增重12.8g是铜的质量,根据电解反应过程中电极上的电子守恒计算;
③依据析出铜的物质的量结合电子守恒计算生成的氢氧化钠的物质的量,来计算浓度.
解答 解:(1)流程①中回收金属铜时,涉及反应为铁与氯化铜的反应,离子方程式为Fe+Cu2+=Fe2++Cu,如将该反应涉及成原电池,则铁为负极,正极可用碳棒,电解质溶液为硫酸铜,装置为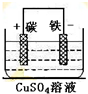 ,
,
故答案为:Fe+Cu2+=Fe2++Cu; ;
;
(2)流程③为氯气和氯化亚铁的反应,方程式为2FeCl2+Cl2=2FeCl3,故答案为:2FeCl2+Cl2=2FeCl3.
(3)①电解硫酸铜溶液生成铜、氧气和硫酸,电解方程式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,电解氯化钠溶液生成氯气、氢气和氢氧化钠,电解方程式诶,
故答案为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH;
②甲池是精炼铜,增重12.8g是铜的质量,物质的量为0.2mol,转移电子物质的量为0.4mol;根据电解反应过程中电极上的电子守恒计算可知;乙槽阳极电极反应为:2Cl--2e-=Cl2↑放出气体物质的量为0.2mol;在标准状况下的体积为4.48L;
故答案为:4.48L;
③依据析出铜的物质的量为0.2mol,电子转移为0.4mol,结合电子守恒和水电离出的氢离子和氢氧根离子守恒计算生成的氢氧化钠的物质的量来计算浓度;电极反应为:2H++2e-=H2↑;减少氢离子物质的量为0.4mol,溶液中增多氢氧根离子物质的量为0.4mol,常温下若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为1mol/L;
故答案为:1mol/L.
点评 本题考查化学工艺流程、原电池等,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意把握原电池的工作原理,电极判断方法,电极反应的书写,电子守恒的计算应用,串联的电解池,电极的分析判断,电路中电子守恒是解题关键.难度不大.


科目:高中化学 来源: 题型:实验题
 实验室制备乙酸正丁酯的化学方程式:
实验室制备乙酸正丁酯的化学方程式:| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度(g•cm-3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点(℃) | 118.0 | 118.1 | 126.1 | 142 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小压强 | B. | 降低温度 | C. | 更换催化剂 | D. | 减小CO的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验方案与步骤 | 实验现象和结论 |
| 1.将少量气体通入盛有少量品红溶液的试管内; | 若品红溶液褪色,则无色气体中有SO2. |
| 2.将气体通过装有足量氢氧化钠溶液的洗气瓶后,用小试管收集气体,并在酒精灯上点燃 | 若收集到气体可以燃烧,则无色气体中有H2. 结合以上实验可知假设三成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H3=-0.33 kJ/mol | |
| B. | 单斜硫转化为正交硫的反应是吸热反应 | |
| C. | △H3<0,单斜硫比正交硫稳定 | |
| D. | △H3>0,单斜硫比正交硫稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -441 kJ/mol | B. | +441 kJ/mol | C. | -882 kJ/mol | D. | +882 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子之间发生的碰撞一定为有效碰撞 | |
| B. | 升高温度,一般可使活化分子的百分数增大,因而反应速率增大 | |
| C. | 对有气体参加的化学反应增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 | |
| D. | 加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com