
| A. | -441 kJ/mol | B. | +441 kJ/mol | C. | -882 kJ/mol | D. | +882 kJ/mol |
分析 1.0g钠与足量的氯气反应,生成氯化钠晶体并放出17.87kJ的热量,即$\frac{1}{23}$molNa与足量的氯气反应,生成氯化钠晶体并放出17.87kJ的热量,结合物质的量与能量变化成正比计算.
解答 解:1.0g钠与足量的氯气反应,生成氯化钠晶体并放出17.87kJ的热量,即$\frac{1}{23}$molNa与足量的氯气反应,生成氯化钠晶体并放出17.87kJ的热量,则生成1mol NaCl的放出热量是17.87kJ×23=411kJ,即生成1mol NaCl的反应热△H=-441 kJ/mol,
故选A.
点评 本题考查反应热与焓变,为高频考点,把握物质的量与能量变化的关系为解答的关键,侧重分析与计算能力的考查,注意热量与焓变的关系,题目难度不大.


科目:高中化学 来源: 题型:实验题
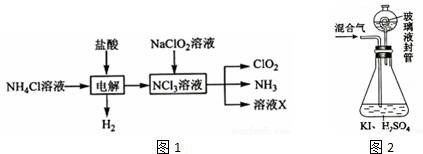
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
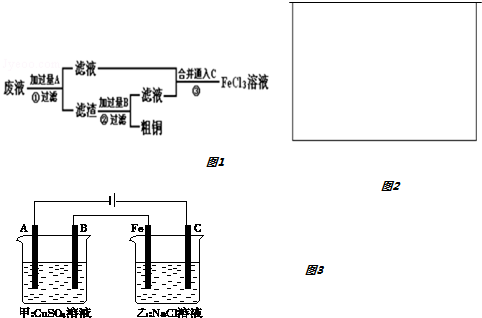
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
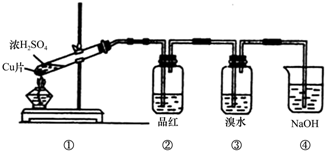
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 溶解性 | 沸点 | 密度(g/mL) | |
| 乙醇 | 与水互溶 | 78.5 | 0.8 |
| 溴乙烷 | 难溶于水 | 38.4 | 1.4 |
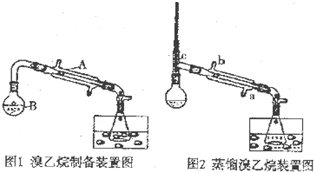
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应在常温下一定是很容易发生 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 由C(石墨)→C(金刚石)△H=+1.9 kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2022 kJ | B. | 2670 kJ | C. | 1698kJ | D. | 2346 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
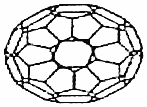
| A. | C60的摩尔质量是720 g•moL-1 | |
| B. | 1 mol C60完全燃烧生成22.4 L CO2 | |
| C. | C60属于有机化合物 | |
| D. | C60的结构与金刚石一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 配制100mL 1.0mol?L-1的氯化钠溶液过程中,
配制100mL 1.0mol?L-1的氯化钠溶液过程中,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com