
| A. | △H3=-0.33 kJ/mol | |
| B. | 单斜硫转化为正交硫的反应是吸热反应 | |
| C. | △H3<0,单斜硫比正交硫稳定 | |
| D. | △H3>0,单斜硫比正交硫稳定 |
科目:高中化学 来源: 题型:实验题
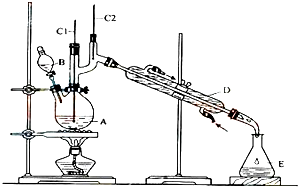 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
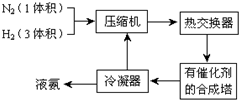
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
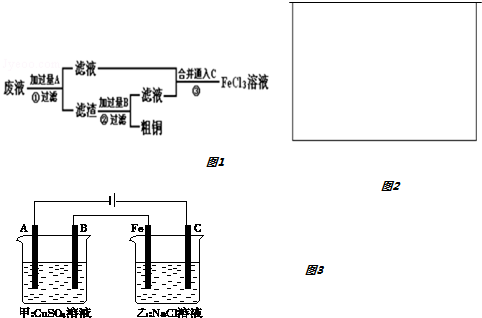
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
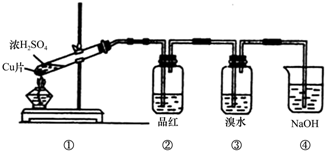
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应在常温下一定是很容易发生 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 由C(石墨)→C(金刚石)△H=+1.9 kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水、盐酸、火碱、硫酸钡 | B. | 水银、硫酸、烧碱、硫酸氢钠 | ||
| C. | 铜、醋酸、石灰石、氯化铜 | D. | 臭氧、硝酸、纯碱、胆矾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com