


科目:高中化学 来源: 题型:
| A、使甲基橙变红的溶液中:Ag(NH3)2+、H+、Na+、NO3- |
| B、0.1 mol?L-1 Fe3+溶液中:Cl-、SO42-、K+、C6H5OH |
| C、“84”消毒液的水溶液中:K+、Cl-、Na+、OH- |
| D、通入过量SO2气体的溶液中:K+、NO3-、Ba2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若t1=15s,生成物C在 t0~t1时间段的平均反应速率为0.004 mol?L-1?s-1 |
| B、t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度 |
| C、B的起始物质的量为0.02 mol |
| D、该化学反应的表达式为:3A(g)?B(g)+2C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若c1=c2,混合液中c(NH4+)=c(Cl-),则V1>V2 |
| B、若混合溶液的pH=7,则c1V1<c2V2 |
| C、若V1≥V2,c1=c2,则混合液的pH>7 |
| D、若混合溶液的pH>7,则混合液中c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 反应时间/min 物质的量浓度/mol?L-1 | 0 | 3 | 10 | 12 |
| C(H2) | 2 | |||
| C(CO) | 0.500 | 0.250 | 0.250 | |
| C(CH3OH) | 0 | 0.500 | 0.750 | 0.750 |
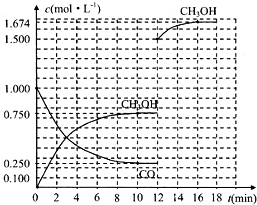
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
| A、①中溶解了5.6gFe |
| B、④中V=6720 |
| C、①的上层清液中含有Fe2+、Fe3+、Cu2+ |
| D、硝酸的浓度为4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤经气化和液化两个物理变化过程,可变为清洁能源 |
| B、棉、麻、丝、毛、皮以及合成纤维完全燃烧只生成H2O和 CO2 |
| C、“地沟油”可用于制备生物柴油 |
| D、石英玻璃、钢化玻璃、玻璃钢、防弹玻璃都是硅酸盐制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 |
| B、放电时OH-向正极移动 |
| C、充电时每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 |
| D、电池充电过程中,KOH的物质的量浓度将增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com