某兴趣小组的学生根据活泼金属Mg与CO
2发生反应,推测活泼金属钠也能与CO
2发生反应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去).已知:常温下,CO能使一些化合物中的金属离子还原.例如:PdCl
2+CO+H
2O=Pd↓+CO
2+2HCl,反应生成黑色的金属钯,此反应也可用来检测微量CO的存在.
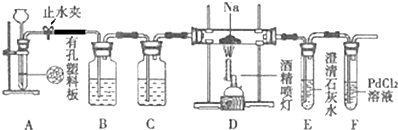
请回答下列问题:
(1)通常实验室制取CO
2气体的离子方程式是
,装置B中应盛放的试剂是
溶液,装置C中应盛放的试剂是
.
(2)检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是
,待装置
(填写字母)中出现
现象时,再点燃酒精喷灯,这步操作的目的是
.
(3)待反应完全后,停止加热,仍继续通二氧化碳,直至反应管冷却.停止加热前是否需要先断开D和E的连接处?为什么?
.
(4)假设CO
2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,取少量固体生成物与足量的盐酸反应后,有能使澄清石灰水变浑浊的气体放出,且固体有剩余,则钠与二氧化碳反应的化学方程式是
.
②若装置F中有黑色沉淀生成,取少量该固体与足量的盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,且固体无剩余,则钠与二氧化碳反应的化学方程式是
.




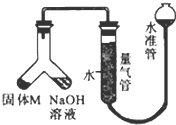 某课外兴趣小组为探究某种铝合金(合金元素为Mg 和Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图装置进行实验.
某课外兴趣小组为探究某种铝合金(合金元素为Mg 和Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图装置进行实验.