
【题目】甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙![]() 沉淀;甲+丙
沉淀;甲+丙![]() 沉淀;乙+丙
沉淀;乙+丙![]() 沉淀;丙+丁
沉淀;丙+丁![]() 沉淀;乙+丁
沉淀;乙+丁![]() 无色无味气体。则甲、乙、丙、丁四种溶液依次是( )
无色无味气体。则甲、乙、丙、丁四种溶液依次是( )
A. BaCl2 Na2CO3 AgNO3 盐酸
B. BaCl2 Na2CO3 盐酸 AgNO3
C. Na2CO3 盐酸 AgNO3 BaCl2
D. AgNO3 盐酸 BaCl2 Na2CO3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 酸性:H3PO4>HClO,因为 H3PO4 的非羟基氧原子数比 HClO 的多
C. 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致
D. 青蒿素分子式为 C15H22O5,结构见图,该分子中包含 7 个手性碳原子

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种元素,其中 A、B、C、D 为短周期主族元素,E、F 为第四周期元素,它们的原子序数依次增大。
A 元素原子的核外 p 电子数比 s 电子数少 3 |
B 元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
C 元素基态原子 p 轨道有 3 个未成对电子 |
D 原子核外所有 p 轨道全满或半满 |
E 在该周期中未成对电子数最多 |
F 能形成红色(或砖红色)和黑色的两种氧化物 |
请根据以上相关信息,回答问题:
(1)A 的卤化物在工业中有重要作用,A 的四种卤化物的沸点如下表所示:
卤化物 | AF3 | ACl3 | ABr3 | AI3 |
沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是_________________。
② ACl3、LiAH4 中A 原子的杂化轨道类型依次为______、_______;与 A3N3H6 互为等电子体的分子的结构简式为___________。
③用AF3分子结构解释反应 AF3(g)+NH4F(s)=NH4AF4(s)能够发生的原因:_________________。
(2)某同学根据上述信息,推断
①B基态原子的核外最子排布为 ,该同学所画的电子排布图违背了________。
,该同学所画的电子排布图违背了________。
② 已知元素 B 的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是________。
A.分子中含有分子间氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键 D.该氢化物分子中 B 原子采用 sp2 杂化
(3)D 基态原子中能量最高的电子,其电子云在空间有______个方向,原子轨道呈______形。
(4)写出 E 原子的电子排布式______________。
(5)请写出 F 元素外围电子排布式_________。向 FSO4溶液中滴加入C元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洛索洛芬钠可用于类风湿性关节炎、肩周炎等炎症的消炎,其合成路线如下:

已知:A分子式为C8H8,E的分子式为C4H6
i.![]()
ii.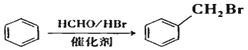
iii.
(1)A属于芳香烃,其名称为_____________。
(2)反应②的反应类型是____________________。
(3)B的结构简式是_________________________。
(4)D中含有的官能团名称____________。
(5)反应①的化学方程式是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在蒸馏实验中,下列叙述不正确的是( )
A. 在蒸馏烧瓶中盛约1/3体积的自来水,并放入几粒沸石
B. 将温度计水银球插入自来水中
C. 冷水从冷凝管下口入,上口出
D. 收集蒸馏水时,应弃去开始馏出的部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以重晶石(主要成分是BaSO4,含Al、Fe等元素的杂质)为原料制备产品(BaCl2·2H2O)的一种流程如下:

已知:滤液2主要含BaCl2,还含有AlCl3、FeCl3和HCl等杂质。298K下,Fe(OH)3、Al(OH)3完全沉淀的pH依次为3.0和5.4。
回答下列问题:
(1)高温焙烧时将重晶石粉碎的目的是______________________。若4.66 g BaSO4完全反应转移9.632×1022个电子,写出BaSO4与C反应的化学方程式:______________________。
(2)“固体”(微溶于水)与盐酸反应生成的一种气体通入CuSO4溶液中产生黑色沉淀,则生成该气体的离子方程式为______________________。滤渣3的成分是___________(填化学式)。
(3)加入BaCO3的目的是____________________________________________。
(4)常温下,Fe3+沉淀完全[溶液中c(Fe3+)=1×10-5mol·L-1]时溶液的pH=3,则Fe(OH)3的Ksp约为_____。
(5)滤液4经蒸发浓缩、降温结晶、过滤,洗涤和干燥,得到产品。采用电化学法以过滤后的废液为原料制备Ba(OH)2,实现资源综合利用和环境保护。气体X的电子式为____________________;写出阴极的电极反应式:__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从原子序数11依次增加到17,下列所述递变关系错误的是( )
A.原子电子层数不变
B.从钠到铝金属性增强
C.最高正价数值逐渐增大
D.从硅到氯负价从-4→-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组拟用下图装置进行钠与氧气反应的实验。

(1)将一小块钠放在石棉网上加热,能观察到的实验现象有______________________, 写出发生反应的化学方程式:________________。
(2)上述实验中还观察到有黑色固体物质生成,其原因可能为2Na+CO2![]() C+Na2O2或4Na+3CO2
C+Na2O2或4Na+3CO2![]() C+2Na2CO3,这两个化学方程式的反应类型既属于基本反应类型中的__________反应,也属于__________(填“氧化还原”或“非氧化还原”)反应。
C+2Na2CO3,这两个化学方程式的反应类型既属于基本反应类型中的__________反应,也属于__________(填“氧化还原”或“非氧化还原”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,H2 + CO2![]() CO+ H2O(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的( )
CO+ H2O(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的( )

A. 平衡时,甲中和丙中H2的转化率是60%
B. 平衡时,乙中CO2的转化率小于60%
C. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
D. 平衡时,丙中c(CO2)是甲中的2倍,是0.008mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com