
【题目】Ⅰ已知铜在常温下能被HNO3溶解。反应方程式为: 3Cu+8HNO3=3Cu(NO3)2+2NO ↑+4H2O
(1)请将上述反应改成离子方程式,并用单线桥法表示电子得失的方向和数目________________。
(2)若生成448mL的NO(标准状况下),则该过程中转移的电子是___________mol。
(3)被还原的硝酸占参加反应硝酸的比例为___________。
Ⅱ某反应体系有反应物和生成物共7种物质:C、H2SO4、K2CrO4、K2SO4、CO2 、Cr2(SO4)3和H2O。已知该反应中发生如下过程:C→CO2。该反应的化学方程式:__________________________。
【答案】![]() 0.06
0.06 ![]() 3C + 10H2SO4 + 4K2CrO4 = 4K2SO4 + 2Cr2(SO4) 3 + 3CO2↑+ 10H2O
3C + 10H2SO4 + 4K2CrO4 = 4K2SO4 + 2Cr2(SO4) 3 + 3CO2↑+ 10H2O
【解析】
(1)硝酸、硝酸铜能拆成离子形式,据此写出该反应离子方程;该反应中铜把电子转移给了硝酸根中氮原子,共转移6e-,用单线桥表示电子转移的防向和数目;
(2)根据反应关系6e----2NO,进行计算;
(3) 由C→CO2可以知道,反应中C为还原剂,CO2为氧化产物,则K2CrO4为氧化剂,对应产物Cr2(SO4)3为还原产物;结合氧化还原反应得失电子守恒及原子个数守恒书写方程式。
(1) 反应方程式为: 3Cu+8HNO3=3Cu(NO3)2+2NO ↑+4H2O;硝酸、硝酸铜均拆成离子形式,剩余物质均不拆,离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;该反应中铜元素化合价升高,共失电子6e-,根据电子得失守恒规律,硝酸根离子中氮原子得到6e-,单线桥法表示该反应电子得失的方向和数目如下:![]() ;综上所述,本题答案是:
;综上所述,本题答案是:![]() 。
。
(2)根据反应关系可知,6e----2NO,448mLNO的物质的量为0.02mol,则该过程中转移的电子0.06 mol;综上所述,本题答案是:0.06。
(3)根据反应可知,8mol HNO3参加反应,被还原的硝酸有2 mol,所以被还原的硝酸占参加反应硝酸的比例为2/8=1/4;综上所述,本题答案是:1/4。
Ⅱ根据题意:C→CO2,反应中C为还原剂,CO2为氧化产物,则K2CrO4为氧化剂,对应产物Cr2(SO4)3为还原产物;C→CO2化合价升高4,2K2CrO4→Cr2(SO4)3化合价共降6,根据得失电子守恒,C系数为3,CO2系数为3, Cr2(SO4)3系数为2,则K2CrO4系数为4,根据原子个数守恒, K2SO4系数为4,H2SO4系数为10,H2O的系数为10,具体为:3C + 10H2SO4 + 4K2CrO4 = 4K2SO4 + 2Cr2(SO4) 3 + 3CO2↑+ 10H2O;综上所述,本题答案是:3C + 10H2SO4 + 4K2CrO4 = 4K2SO4 + 2Cr2(SO4) 3 + 3CO2↑+ 10H2O。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】根据如图回答,下列说法正确的是
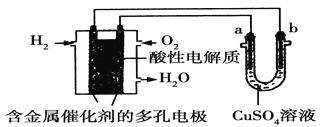
A. 此装置若用于铁表面镀铜时,a为铁。
B. 此装置若用于电镀铜时,硫酸铜溶液的浓度逐渐变小。
C. 燃料电池中正极反应为:O2+4e-+2H2O===4OH-
D. 若用该装置进行粗铜的精炼,当有1 mol水生成时,b电极上增重63.5 g,a电极下方有部分重金属泥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活中的化学小实验不合理的是
A.用灼烧并闻气味的方法区分化纤织物与纯毛织物
B.用食用醋除去热水瓶中积存的水垢
C.用纯碱溶液洗涤沾有油污的器具
D.用米汤检验加碘盐中的碘酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、前20号元素A、B、C、D,其中A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)C在周期表中的位置__________________________;
(2)B 元素的原子结构示意图____________________________;
(3)化合物D2C的电子式______________________________;
(4)B最简单气态氢化物与最简单的有机物的稳定性强弱关系(用相应的化学式表示):____ > ____;
(5)C、D离子的半径大小关系为C______D (填:>、=、<);
(6)B的氢化物与B的最高价氧化物对应水化物反应的生成物中含有的的化学键有__________填选项)。
A、只含离子键 B、既有离子键又有共价健
C、只含有共价键 D、既有极性共价键又有非极性共价键
Ⅱ、利用下图装置来验证同主族元素非金属性的变化规律:

(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾溶液,观察到C中溶液现象是:___________,即可证明。干燥管D的作用是___________________。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用_________________溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,将观察到C中______________的现象。但老师认为,该现象不足以证明酸性强弱关系为碳酸>硅酸,因此应在B、D之间增加一个盛有足量__________的洗气装置(选填下列字母)
A.浓盐酸 B.浓NaOH溶液 C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷和砷的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态As原子的核外电子排布式为[Ar]_________;As原子的逐级电离能(kJ/mol)数据如下:
第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | 第五电离能 | 第六电离能 |
947.0 | 1798 | 2735 | 4837 | 6043 | 12310 |
第五电离能与第六电离能相差显著的原因:_____________________________________。
(2)红磷是巨型共价分子,无定型结构。能证明红磷是非晶体的最可靠方法是__________。
A.质谱 B.原子发射光谱 C.核磁共振谱 D.X射线衍射
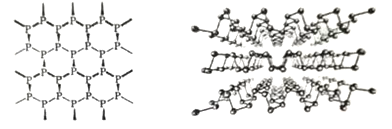
(3)黑磷是新型二维半导体材料,具有类似石墨一样的片层结构(如图),层与层之间以_____结合。从结构上看,单层磷烯导电性优于石墨烯的原因是____________________________。
(4)白磷(P4)分子是正四面体结构,3.1g白磷中σ键的数目为________;白磷(P4)易溶于二硫化碳,难溶于水,其原因是_____________________________________________。
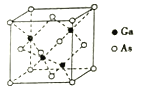
(5)GaAs的熔点为1238℃,其晶胞结构如图所示。该晶体的类型为_________,Ga原子的杂化方式为______________,每个As原子周围最近的As原子数目为________。已知GaAs的密度为dg/cm3,摩尔质量为Mg/mol,则晶胞中最近的As和Ga原子核间距为_____(阿伏加德罗常数值用NA表示,列出算式即可)nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以NaBH4(B为+3价)和H2O2做原料的新型燃料电池可用作深水勘探等无空气环境下的电源,其结构如右图所示.该电池总反应式为:NaBH4+4H2O2=NaBO2+6H2O,下列的说法正确是( )
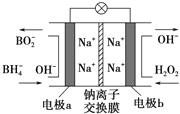
A. 放电过程中,Na+从右向左迁移
B. a为正极,其电极反应为:BH4--8e-+8OH-=BO2-+6H2O
C. b电极的电极反应式为:H2O2+2e-+2H+=2H2O
D. 每消耗300g、34%的H2O2溶液,理论上流过电路中的电子数为6NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣(有效成分为 Fe2O3 和 Fe3O4)制备 PFS,其工艺流程如下图所示。
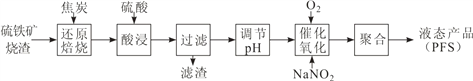
(1)CO是“还原焙烧”过程的主要还原剂。下图中,曲线表示 4 个化学反应 a、b、c、d 达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是 Fe2O3、Fe3O4、FeO、Fe 稳定存在的区域。a属于__________(填“吸热反应”或“放热反应”);570℃时,d 反应的平衡常数 K=___________________。
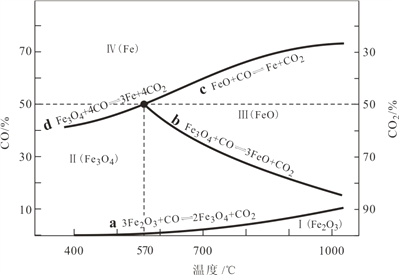
(2)800℃,混合气体中CO2的体积分数为40%时,Fe2O3用CO还原焙烧过程中发生的主要的化学反应方程式:________________________________________________
(3)若“酸浸”时间过长,浸出液 Fe2+含量反而降低,主要原因是___________________。
(4)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17,Ksp[Fe(OH)3]=1.0×10-39。若浸出液中c(Fe3+) = 10-1.8mol·L-1,为避免“催化氧化”过程中产生副产物 Fe(OH)3,应调节浸出液的 pH≤___________。
(5)FeSO4 溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4 ,该反应的离子方程式_____________________________________.
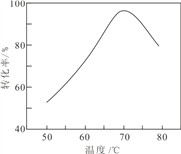
(6)“催化氧化”过程中,用 NaNO2 作催化剂(NO 起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+ 转化率随温度的升高先上升后下降的原因是___________________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com